网址:http://m.1010jiajiao.com/timu_id_4449304[举报]
(08山东省威海市质检)(8分)测定一定体积的NaOH和Na2CO3混合溶液中NaOH的含量:取20mL溶液,加入足量BaCl2溶液后,滴入几滴酚酞,再用0.10mol?L-1盐酸进行滴定。
(1)用盐酸进行滴定之前不需要过滤以除去BaCO3的的理由是
(2)达到终点时,溶液的颜色变化是 ;
(3)达到终点时消耗25.0mL 的HCl,则原混合液中NaOH的含量为 g/mL;
(4)若向含有大量BaCO3固体的浊液中,分别加入下列试剂,则发生的变化是:
①加入少量BaCl2固体,则c(Ba2+) c(CO32+) (填“增大”、“减少”)。
②加入少量稀盐酸,则Ksp(BaCO3) (填“增大”、“减少”或“不变”)。
查看习题详情和答案>>(08山东省威海市质检)(8分)I.(1)已知298K时2C(s)+O2(g)=2CO(g) △H1=-221.01kJ?mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5kJ?mol-1 则298K时CO(g)在O2(g)燃烧生成CO2(g) 的热化学反应方程式为:________。
(2)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。
该电池工作时的负极反应式为: ;
熔融盐中CO32-的物质的量在工作时 (填“增大”、“减少”、“不变”)。
|
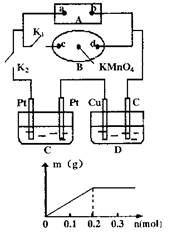
II.如右图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D
为电解槽,其电极材料及电解质溶液见图。
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源a端为 极,通电一段时间后,观察到滤纸d端出现的现象是: ;
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示。则Cu2+、X3+、H+氧化能力由大到小的顺序是 ;D装置Cu极的电极反应式为 。
查看习题详情和答案>>
(08山东省威海市调研)近几年一种新型的甜味剂木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中不正确的是()
A.木糖醇与葡萄糖、果糖不一样,它不属于单糖
B.木糖醇不能跟新制的氢氧化铜浊液反应生成红色沉淀
C.木糖醇与乙醇属于同系物
D.木糖醇是一种五元醇,可以与羧酸在一定条件下发生酯化反应
查看习题详情和答案>>