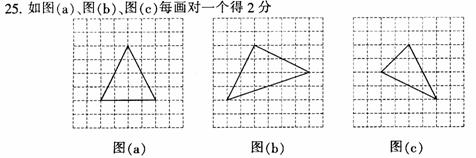
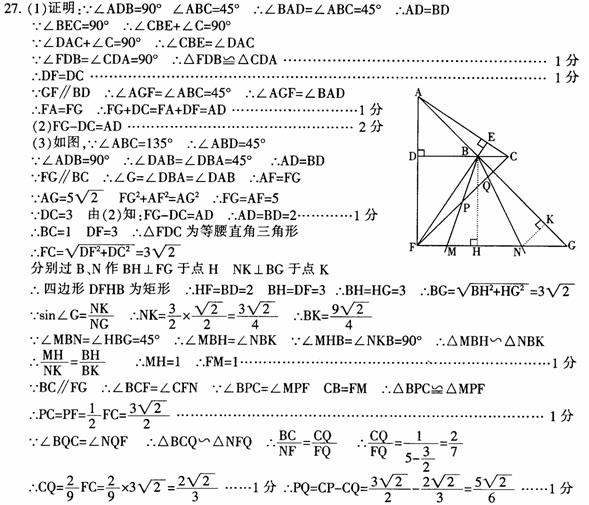
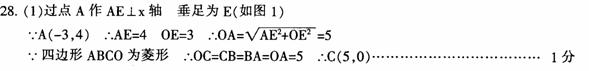1、 把化学反应分成氧化还原反应、非氧化还原反应和四种基本类型反应,是两种不同的分类方法。前者分类根据化学反应实质,后者分类根据反应物、生成物种类的多少和类别,所以从分类的根据上看,前者较后者更深入本质。
把化学反应分成氧化还原反应、非氧化还原反应和四种基本类型反应,是两种不同的分类方法。前者分类根据化学反应实质,后者分类根据反应物、生成物种类的多少和类别,所以从分类的根据上看,前者较后者更深入本质。
化学反应的不同分类方法的关系是:
|
基本类型 |
氧化还原反应 |
非氧化还原反应 |
|
化合 |
2Cu+O2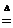 2CuO 2CuO |
CaO+H2O=Ca(OH)2 没有单质参加反应 |
|
分解 |
2KClO3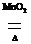 2KCl+3O2↑ 2KCl+3O2↑ |
NH4HCO3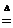 NH3↑+H2O+CO2↑ 没有单质生成 NH3↑+H2O+CO2↑ 没有单质生成 |
|
置换 |
Fe+2HCl=FeCl2+H2↑ |
|
|
复分解 |
|
H2SO4+Ba(OH)2=BaSO4↓+2H2O |
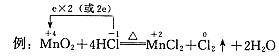
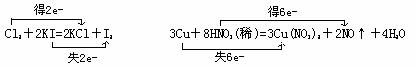
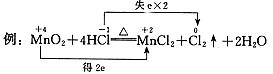
 要点:(1)双箭号(从反应物指向生成物);
要点:(1)双箭号(从反应物指向生成物);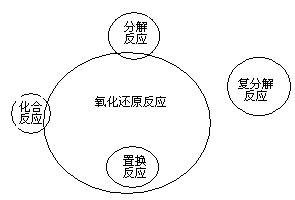
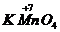 、
、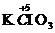 、浓
、浓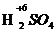 、
、 、
、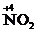 …。
…。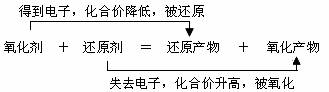

 解析:二氧化硫中硫元素的化合价由+4下降到0,二氧化硫被还原,做氧化剂;硫化氢中硫元素化合价由-2升高到0,硫化氢被氧化,做还原剂。每生成3molS中,有2molS是硫化氢中-2价的硫被氧化而来的,属氧化产物,有1molS是二氧化硫中的+4价的硫被还原来的,属还原产物,所以氧化产物与还原产物的物质的量之比是2:1。
解析:二氧化硫中硫元素的化合价由+4下降到0,二氧化硫被还原,做氧化剂;硫化氢中硫元素化合价由-2升高到0,硫化氢被氧化,做还原剂。每生成3molS中,有2molS是硫化氢中-2价的硫被氧化而来的,属氧化产物,有1molS是二氧化硫中的+4价的硫被还原来的,属还原产物,所以氧化产物与还原产物的物质的量之比是2:1。