摘要: 双线桥--表示电子得失的结果 要点:(1)双箭号, (2)箭号起.止所指为同一种元素, (3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数).
网址:http://m.1010jiajiao.com/timu_id_4432289[举报]
现有下列10种物质:①铁片;②饱和食盐水;③液态硫酸;④乙醇;⑤干冰;⑥熔融硝酸钾;⑦碳酸钙固体;⑧铝条;⑨苛性钠;⑩石墨.
(1)用序号回答:能导电的是
(2)写出①与水反应的化学方程式,并用双线桥表示电子转移的方向和数目.

(3)写出⑧与⑨的水溶液反应的离子方程式
(4)储氢纳米碳管的研制成功体现了科技的进步.用电弧法合成的碳纳米管常伴有大量的杂质--碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯. C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种.
请用上述物质填空,并配平化学方程式:

若该反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为
查看习题详情和答案>>
(1)用序号回答:能导电的是
①、②、⑥、⑧、⑩
①、②、⑥、⑧、⑩
,属于电解质的是③、⑥、⑦、⑨
③、⑥、⑦、⑨
,属于非电解质的是④、⑤
④、⑤
.(2)写出①与水反应的化学方程式,并用双线桥表示电子转移的方向和数目.


(3)写出⑧与⑨的水溶液反应的离子方程式
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
,该反应的氧化剂为H2O
H2O
,还原产物为H2
H2
.(4)储氢纳米碳管的研制成功体现了科技的进步.用电弧法合成的碳纳米管常伴有大量的杂质--碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯. C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种.
请用上述物质填空,并配平化学方程式:

若该反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为
4.48L
4.48L
.(1)2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O 氧化剂是
(2)MnO2+4HCl═MnCl2+2H2O+Cl2↑ MnO2被
(3)6KOH+3Cl2=5KCl+KClO3+3H2O,请用双线桥表示电子的转移,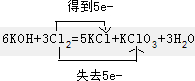
 .
.
查看习题详情和答案>>
Cl2
Cl2
还原剂是Cl2
Cl2
(2)MnO2+4HCl═MnCl2+2H2O+Cl2↑ MnO2被
还原
还原
HCl被氧化
氧化
(填“氧化”或“还原”)(3)6KOH+3Cl2=5KCl+KClO3+3H2O,请用双线桥表示电子的转移,


经常有人因误食亚硝酸钠(NaNO2)而中毒,原因是NaNO2像食盐一样既有咸味,又有很强毒性.已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O
(1)HI表现的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)用双线桥表示电子转移的方向和数目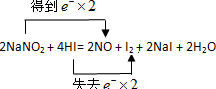

(3)当此反应中转移的电子数为2.408×1023时,被氧化的HI物质的量为
查看习题详情和答案>>
(1)HI表现的性质是
B
B
(填序号)A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)用双线桥表示电子转移的方向和数目


(3)当此反应中转移的电子数为2.408×1023时,被氧化的HI物质的量为
0.4mol
0.4mol
.经常有人因误食亚硝酸钠(NaNO2)而中毒,原因是NaNO2像食盐一样既有咸味,又有很强毒性.已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O.
(1)在此反应中,氧化剂是
(2)用双线桥表示电子转移的情况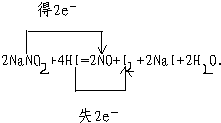
 .
.
(3)若有1mol还原剂被氧化,则在此反应中发生转移的电子数目为
查看习题详情和答案>>
(1)在此反应中,氧化剂是
NaNO2
NaNO2
(填化学式),氧化产物是I2
I2
(填化学式).(2)用双线桥表示电子转移的情况


(3)若有1mol还原剂被氧化,则在此反应中发生转移的电子数目为
NA
NA
.Na2O2可用作漂白剂和呼吸面具中的供氧剂.
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞试液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生.
①使酚酞试液变红是因为 ,红色褪去的可能原因是 .
②加MnO2粉末后发生的反应 .
写出Na2O2作供氧剂的反应方程式,并用双线桥表示电子转移的数目 .
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应.为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下.
步骤1:按图组装仪器(图中夹持仪器省略),检查气密性,装入药品;
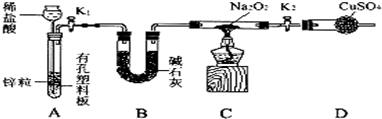
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象;
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1.
①盛装稀盐酸的仪器名称 ;B装置的作用是 .
②必须检验氢气纯度的原因是 .
③设置装置D的目的是 .
④你得到的结论是 (若能反应请用化学方程式表示).
查看习题详情和答案>>
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞试液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生.
①使酚酞试液变红是因为
②加MnO2粉末后发生的反应
写出Na2O2作供氧剂的反应方程式,并用双线桥表示电子转移的数目
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应.为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下.
步骤1:按图组装仪器(图中夹持仪器省略),检查气密性,装入药品;

步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象;
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1.
①盛装稀盐酸的仪器名称
②必须检验氢气纯度的原因是
③设置装置D的目的是
④你得到的结论是