摘要: 单线桥--表示电子转移情况 要点:(1)单箭号, (2)箭号起点为被氧化元素.终点为被还原元素, (3)只标转移电子总数.不标得与失(氧化剂得电子总数等于还原剂失电子总数). 例5.判断下列反应哪些是氧化还原反应.哪些是非氧化还原反应?是氧化还原反应的用单线桥表示电子转移的方向和数目.并指出氧化剂和被氧化的物质. (1)Cl2+2KI=2KCl+I2 2+CO2+H2O=CaCO3↓+2HClO (3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 解析: (1)中氯元素化合价由0下降到-1.被还原.Cl2是氧化剂,碘元素化合价由-1升高到0.被氧化.KI是被氧化的物质.(3)氮元素化合价由+5下降到+2.被还原.硝酸是氧化剂,铜元素化合价由0升高到+2.被氧化.铜是被氧化的物质,(2)中无元素化合价变化.是非氧化还原反应 答案:是氧化还原反应.(2)是非氧化还原反应. (1)中Cl2是氧化剂.KI是被氧化的物质,(3)中硝酸是氧化剂.铜是被氧化的物质. [强化训练]
网址:http://m.1010jiajiao.com/timu_id_4432290[举报]
学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3?6H2O晶体.(图中夹持及尾气处理装置均已略去)

(1)回答下列问题:所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为
A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸 D.FeCl3溶液
此步涉及反应的离子方程式为
(2)反应发生后装置B中发生反应的化学方程式是
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3?6H2O晶体,设计流程如下:
滤液
FeCl3
FeCl3?6H2O晶体
①用离子方程式表示步骤I中通入Cl2的作用
 (用单线桥表示电子转移的方向和数目)
(用单线桥表示电子转移的方向和数目)
②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明.
向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液.你认为此方案是否合理
查看习题详情和答案>>

(1)回答下列问题:所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为
B
B
(填序号).A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸 D.FeCl3溶液
此步涉及反应的离子方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
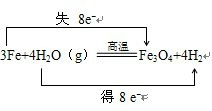
.经除杂后的铁粉进一步干燥后装入反应容器.(2)反应发生后装置B中发生反应的化学方程式是
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
.D装置的作用:
| ||
除去H2中的水蒸气
除去H2中的水蒸气
.(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3?6H2O晶体,设计流程如下:
滤液
| Cl2 |
| I |
| II |
①用离子方程式表示步骤I中通入Cl2的作用


②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明.
向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液.你认为此方案是否合理
不合理
不合理
(填”合理”或”不合理”).按要求书写化学式
①Al2(SO4)3(写出电离方程式):
②请写出硝酸和氢氧化钠反应的离子方程式:
⑦用单线桥表示电子转移方向和数目: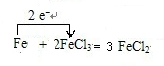
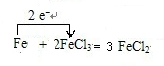
Fe+2FeCl3=3FeCl2.
查看习题详情和答案>>
①Al2(SO4)3(写出电离方程式):
Al2(SO4)3=2Al3++3SO42-
Al2(SO4)3=2Al3++3SO42-
②请写出硝酸和氢氧化钠反应的离子方程式:
H++OH-=H2O
H++OH-=H2O
⑦用单线桥表示电子转移方向和数目:
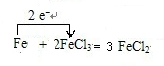
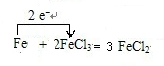
Fe+2FeCl3=3FeCl2.
A、B、C、D、E五种元素,它们的原子序数依次增大,且都是周期表中前20号元素.A原子基态时,p能级上有三个未成对电子;B元素的原子基态时,s能级与p能级的电子数相等;B、C同周期,且C是本周期中电负性最大的元素;D原子的第一至第四电离能(kJ/mol)分别为578、1817、2745、11575;E元素原子中4s能级处于全充满状态.
(1)A的氢化物沸点比同族元素其他氢化物沸点高的原因是
(2)研究表明,B、C能形成一种三原子分子,且该分子中所有原子都达到8电子稳定结构,则该分子的结构式为
(3)A、D两元素最高价氧化物对应的水化物能发生反应,其离子方程式为
(4)E的氢化物常做野外生氢剂,只要将其与H2O混合立即产生大量的H2,写出该反应的化学方程式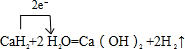
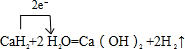 .
.
查看习题详情和答案>>
(1)A的氢化物沸点比同族元素其他氢化物沸点高的原因是
NH3分子间有氢键
NH3分子间有氢键
;在微电子工业中,其氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3?H2O+3H2O2=N2↑+8H2O
2NH3?H2O+3H2O2=N2↑+8H2O
.(2)研究表明,B、C能形成一种三原子分子,且该分子中所有原子都达到8电子稳定结构,则该分子的结构式为
F-O-F
F-O-F
.(3)A、D两元素最高价氧化物对应的水化物能发生反应,其离子方程式为
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O
.(4)E的氢化物常做野外生氢剂,只要将其与H2O混合立即产生大量的H2,写出该反应的化学方程式
CaH2+2H2O=Ca(OH)2+2H2↑
CaH2+2H2O=Ca(OH)2+2H2↑
并用单线桥表示电子转移的方向和数目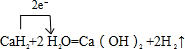
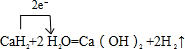
(1)K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O (用“单线桥”表示电子转移的方向和数目)氧化剂是 ,氧化产物与还原产物的物质的量之比为 .
(2) mol H2O中共含有9.03×1022个原子,其质量为 .
(3)配平下列氧化还原反应方程式:
KMnO4+ H2S+ H2SO4(稀)- MnSO4+ S↓+ K2SO4+ H2O
(4)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为 L.
查看习题详情和答案>>
(2)
(3)配平下列氧化还原反应方程式:
(4)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为