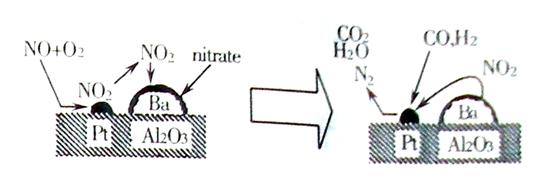
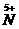26.(10分)某化学研究小组对当地的石灰石样品进行了研究。称取石灰石样品8g,把40g稀盐酸分四次加入样品中,测得实验数据见下表(假设石灰石样品中杂质不溶于水、不与盐酸反应,二氧化碳不溶解)。
|
实验序号 |
加入稀盐酸的质量/g |
剩余物质的质量/g |
|
第1次 |
10 |
5.5 |
|
第2次 |
10 |
3 |
|
第3次 |
10 |
1.6 |
|
第4次 |
10 |
m |
(1)第4次剩余物质的质量m= g
(2)石灰石样品中CaCO3的质量分数为 。
(3)计算稀盐酸的溶质质量分数。
25.(12分)已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计实验探究该粉末中铁、铜的存在。
资料在线:铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(2Al+2H2O+2Na0H=2NaAlO2+3H2↑),铁和铜不与氢氧化钠溶液反应。
可供选择的实验用品:烧杯、大试管、量筒、滴管、燃烧匙、药匙、磁铁;稀硫酸、稀盐酸、Na0H镕液、氨水。
请你参与并完成以下实验探究过程:
Ⅰ、提出假设
假设1:该混合金属粉末中除铝外还含有Fe。
假设2:该混合金属粉末中除铝外还含有 。
假设3:该混合金属粉末中除铝外还含有Fe、Cu。
Ⅱ、设计并实施实验方案
(1)基于假设1,不用化学试剂,证明金属铁的存在
。
(2)基于假设2,将混合金属粉末加入足量稀盐酸,你观察到的现象是
,反应的化学方程式为 。
(3)基于假设3,请你完成实验操作,描述实验现象。
|
实验步骤 |
实验操作(说明仪器和试剂) |
实验现象 |
结论 |
|
① |
|
|
仅除去铝 |
|
② |
|
|
证明含有铁 |
|
③ |
将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 |
剩余固体呈紫红色 |
证明含有铜 |
19. 在密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如
下表:
|
物质 |
X |
Y |
Z |
Q |
|
反应前质量/g |
8 |
2 |
20 |
5 |
|
反应后质量/g |
待测 |
10 |
8 |
13 |
下列说法正确的是( )
A.反应后X的质量为6g
B.该反应的反应物是X、Y
C.参加反应的X、Z的质量比是1:3
D. Y、Q的相对分子质量比一定为1:1
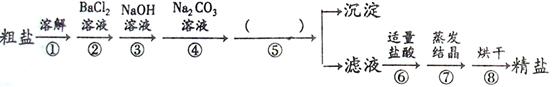
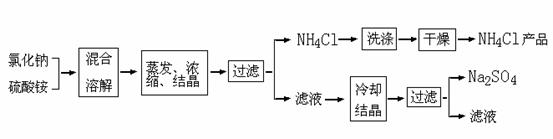
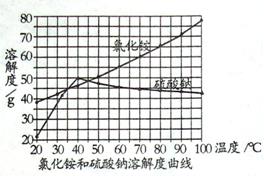 ⑴工业上生产的氯化铵属于
(填写序号)。
⑴工业上生产的氯化铵属于
(填写序号)。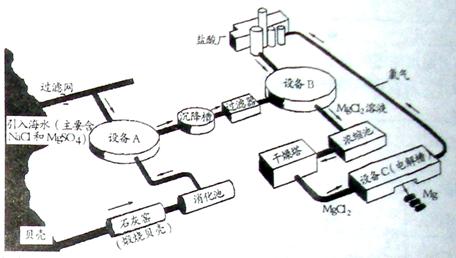

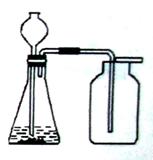 小亮同学设计右图装置来制取并收集气体,你认为他能制得的气体是( )
小亮同学设计右图装置来制取并收集气体,你认为他能制得的气体是( )