6.向含有0.14mol Na2CO3的溶液中逐滴加入含有HCl 0.2mol的稀盐酸,经充分反应后,溶液中各物质的物质的量(mol)正确的是( )
|
|
Na2CO3 |
HCl |
NaCl |
NaHCO3 |
|
A |
0 |
0 |
0.20 |
0.08 |
|
B |
0.40 |
0 |
0.20 |
0 |
|
C |
0 |
0.06 |
0.14 |
0.14 |
|
D |
0 |
0 |
0.06 |
0.08 |
(二)乙组:

实验装置:

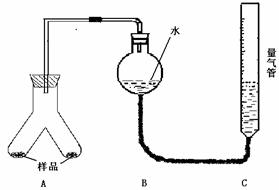
实验步骤:
①图连接好装置
 ②称取两份质量均为0.3g
的镁铝合金样品粉末,分别放入A装置左右两个管中,向B装置中加入一定量的水,把装置A、B的胶塞塞好,然后调节C的高度使B和C中的液面相平,记录下此时的体积为112 mL
②称取两份质量均为0.3g
的镁铝合金样品粉末,分别放入A装置左右两个管中,向B装置中加入一定量的水,把装置A、B的胶塞塞好,然后调节C的高度使B和C中的液面相平,记录下此时的体积为112 mL
③通过注射器的针头向装置A左侧管中注入足量的稀盐酸,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为448mL
④通过另一针头向装置A右侧管中加入足量的稀NaOH溶液,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为672mL。
问题和讨论:
(1)上述实验步骤①和②之间必须加一步 的操作,具体方法为 。
(2)为使气体体积测定结果不至于引起很大偏差,除了应注意使B和C中的液面相平外,在反应完全后至读数之前,还需要注意的关键问题是(只需写出1点) 。
(3)计算合金中铝的质量分数时,是否需要将气体体积折算为标准状况的体积 。
17.(5分)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案(见下图)
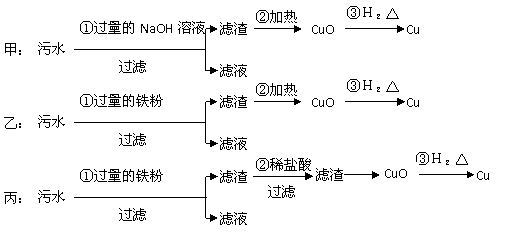


(1)甲、乙、丙提出的实验方案是否能得到纯净的金属铜?
甲 ,乙 ,丙 (填“能”或“不能”)。
(2)在能制得铜的方案中,哪一步操作会导致环境污染? 。应增加哪些措施防止污染? 。
18.(10分)A、B、C、D、E为易溶化合物,其离子组成为
|
阳离子 |
Fe3+、Ba2+、Al3+、Na+、Ag+ |
|
阴离子 |
NO3-、OH-、SO42-、Cl-、CO32- |
在各化合物中离子不重复,分别取其溶液进行实验,结果如下:
①在A溶液中逐滴加入氨水,有白色沉淀生成,继续加氨水至过量,沉淀消失;
②用pH试纸测得B和C溶液显碱性,0.1mol/L的C溶液pH小于13;
③在D溶液中加入铁粉,溶液质量增加;
④在E溶液中加入过量B,没有沉淀产生。
完成下列填空:
(1)A的化学式为 ;
(2)③反应的离子方程式为 ;
(3)检验D溶液中阴离子的的方法是 ;
 (4)E的的化学式为
,将E蒸干、灼热至质量不再改变,最后所得物质是(填化学式)
。
(4)E的的化学式为
,将E蒸干、灼热至质量不再改变,最后所得物质是(填化学式)
。
19. (10分)有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,W、K为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和W反应可放出大量的热。
(10分)有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,W、K为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和W反应可放出大量的热。
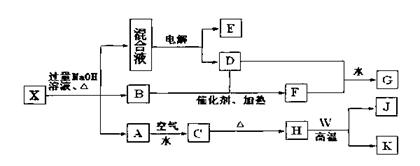
请回答下列问题:
(1) B气体的检验方法为 。
(2)按要求写出上述转化关系中有关反应的化学方程式:
①含有K元素的化合反应 。
②含有K元素的置换反应 。
(3) K与过量G的稀溶液反应的离子方程式为 。
(4) 物质X的化学式为 。
20.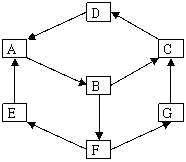 (10分)某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示
(10分)某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示
已知①A、B、C、D、G含有同种元素。
②
|
|
 纯A(单质) 纯A(单质) |
B溶液 |
D固体 |
G溶液 |
|
颜色 |
银白色 |
黄色 |
红棕色 |
浅绿色 |
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
 依据以上信息填空:
依据以上信息填空:
(1)写出D的化学式 。
(2)G生成C的过程中所出现的现象为 。
(3)写出下列反应的化学方程式:
E→A ; A→B 。
(4)B→F的离子方程式为 。
21.(6分)现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物试样0.506g,加热至质量不再变化为止,将生成的气体用足量的澄清石灰水吸收,得到白色沉淀0.200g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体充分干燥后通过足量的过氧化钠粉末,过氧化钠粉末的质量增加0.084g。试回答:
(1)混合物中酸式碳酸盐物质的量为 mol。
(2)加热后残留固体中两碳酸盐物质的量之和为 mol。
(3)通过计算和推理确定混合物中两种盐的化学式分别为 。
 测定剩余固体质量
测定剩余固体质量