21.(7分)现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,C和D结合生成化合物丁。B、C、D三种元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:
|
|

 B(单质) 甲
B(单质) 甲
|
 乙
C(单质)
乙
C(单质)
又知甲、乙、丙分子含有相同数目的质子。
(1)根据以上条件,可以确定A、B、C、D四种元素中三种,不能被确定的第四种元素是___ __ ___ (填写选项的编号,下同 )( ①A ②B ③C ④D)
写出转化关系图中已确认的反应的化学方程式:__________ __________________,
(2)以下四个补充条件中的任何一个都可以进一步确定第四种元素,其中一个条件推断出的第四种元素与其余三个条件推断出的第四种元素不同,这个条件是__ _____(填序号)
依据该条件推断,第四种元素是_____________(填元素符号)。
①化合物甲与丙、乙与丙均能够发生反应
②化合物甲、乙、丙都是无色物质,其中只有甲有刺激性气味
③通常情况下乙和丁不发生反应,若将乙、丁、单质C混合,立即发生化合反应。
④单质C和化合物丁不能共存。
(3)依据该(2)小题中的第③个补充条件推断出第四种元素。且已知丙和丁在一定条件下能发生化学反应。试写出此化学反应方程式:________________________________
20、(10分)工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3……………………………………①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl………………②
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
⑴ 业所制纯碱中常含有少量的氯化钠杂质,其原因 ,
(2)现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
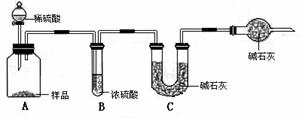
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2NaCl+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物冷却至室温后称量得固体质量为11.03g。
请分析、计算后填表:
|
分析与 计算 分组 |
计算样品中碳酸钠 的质量分数 |
对实验结果 的评价 |
实验失败的主要原因 及对结果的影响 |
|
甲组 |
|
失败 |
|
|
乙组 |
|
成功 |
/ |
|
丙组 |
|
成功 |
/ |
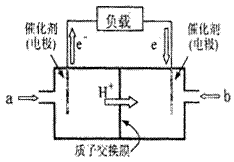 右图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结 构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH30H+302→2C02+4H20。下列说法正确的是
右图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结 构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH30H+302→2C02+4H20。下列说法正确的是