19.已知下列两个热化学方程式:
H2(g) + 1/2O2(g) = H2O(l); △H= -285kJ/mol
C3H8(g) + 5O2(g) = 3CO2(g)+ 4H2O(l); △H= -2220.0kJ/mol
(1) 实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比____________;
(2) 已知:H2O(l) = H2O(g); △H= +44.0kJ/mol。写出丙烷燃烧生成二氧化碳和气态水的热化学方程式______________________________。
20.有一环保汽车,是以氢气作燃料的,请按题要求回答:
(1) 氢气在发动机内燃烧的过成中,生成物只有水蒸气,不会使空气中的________含量偏高,因而能够减缓温室效应现象的发生。
(2) 如果每摩尔氢气燃烧后生成水蒸气并放出241.8kJ的热量,写出氢气燃烧的热化学方程式_______________________________________ 。
|
|
|
∣ ∣ ∣
↓ ↓ ↓
|
|||||||||
|
|||||||||
|
|
|
|||||||
|
---→ ---→ ---→ ---→ ----→
① ④
(1)操作①可选择的主要仪器是 仪器。
(2)操作②不用硝酸钡溶液的理由是 。
(3)操作④的目的是 。
22.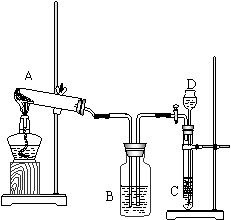 我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高,并能进行连续生产,从而享誉中外。“侯氏制碱法”的基本做法是向饱和盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即得到纯碱。它的反应原理可用下列化学方程式表示:
我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高,并能进行连续生产,从而享誉中外。“侯氏制碱法”的基本做法是向饱和盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即得到纯碱。它的反应原理可用下列化学方程式表示:
NaCl(饱和)+ NH3 + CO2 + H2O = NaHCO3↓+ NH4Cl
△
2NaHCO3 = Na2CO3 + CO2↑ + H2O
某课外兴趣小组同学,按照“侯氏制碱法”原理,
设计了如下一套实验装置见图1。
实验室可选药品有浓氨水,纯碱,大理石,稀盐酸,
稀硫酸,熟石灰,氯化铵,氯化钠
(1)选用最合适的试剂名称A _____________;D 。
(2)本实验具体操作过程中,应先通 气体,再通 气体;原因是 。
(3)指出该装置的至少两处错误:
(4)在改进装置后,该同学进行了实验,实验所用的饱和NaCl溶液中含溶质58.5g,实验最后得到无水碳酸钠26g,则其产率为 ;该同学针对其实验结果,认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是 。
(5)在“侯氏制碱法”的工业生产中,原料的利用率高,大大降低了成本。请问本实验中那些物质可重复利用? 。
23.(1)配平下列离子反应方程式
Fe(OH)3 + ClO- + OH- → ___ FeO4n- + Cl- + H2O
(2)已知有3.21gFe(OH)3参见反应,共转移了5.4×1022 个电子,则n= , FeO4n-中铁元素的化合价为 。
(3)根据(1),(2)推测,FeO4n-能和下列 (填序号)物质反应。
A.KMnO4 B.SO2 C.H2S D.O2
24. 过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带数量不等的结晶水。为分析某过氧化钙样品的组成,进行了如下实验:
18.在一定条件下化学反应2SO2(g)+O2(g)≒2SO3(g); △H=-197kJ/mol,现有容积相等的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
|
容器 |
SO2(mol) |
O2(mol) |
SO3(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
2 |
1.7 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述正确的是
A.热化学方程式2SO2(g)+O2(g)≒2SO3(l); △H﹥-197kJ/mol
B.Q1=2Q2=2Q3=197
C.Q1=2Q3﹤2Q2﹤197
D.2Q3﹤Q1﹤Q2﹤197
17.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是
|
|
50ml盐酸 |
50ml盐酸 |
50ml盐酸 |
|
M(混合物) |
9.2g |
15.7g |
27.6g |
|
VCO2(标况) |
2.24L |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0mol/L
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸反应