27、(10分)如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计的实验方案如下
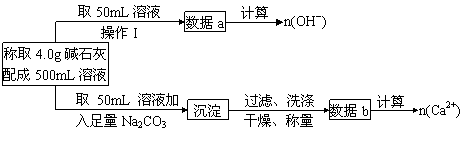

①下列关于溶液中n(Na+)的计算式中正确的是________。(填序号)
a.n(Na+) = n(OH-) - 2n(Ca2+) b.n(Na+) = [n(OH-)- n(Ca2+)]/2
c.n(Na+) = 2n(OH-)- n(Ca2+)
②现有4.0g碱石灰,设其中n(OH-)=x mol,n(Ca2+)=y mol,请填写下表:
|
碱石灰的 可能组成 |
NaOH,CaO |
NaOH,CaO , Ca(OH)2 |
NaOH,Ca(OH)2 |
NaOH, Ca(OH)2,H2O |
|
x、y之间关系式(等式或不等式) |
|
40x-24y<4.0<40x-6y |
|
|
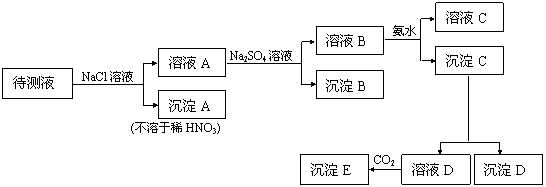
(2)第二小组查得如下资料:氢氧化钙在250℃时不分解,氢氧化钠在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.7g 。请通过计算确定该碱石灰各成分的质量分数。

|
|||||||||||
 |
|||||||||||
|
|||||||||||
|
|||||||||||
|
|||||||||||
|


2007届江苏省西亭高级中学高三化学10月份综合训练
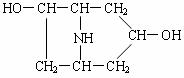
 (1)该有机物的结构简式为________________。
(1)该有机物的结构简式为________________。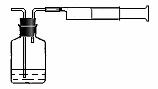 ⑵我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg·m-3。小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置:
⑵我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg·m-3。小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置: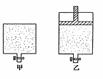 (6分) 有甲、乙两个密闭容器,如图所示,甲容器能保持容积恒定,乙容器能保持压强恒定:
(6分) 有甲、乙两个密闭容器,如图所示,甲容器能保持容积恒定,乙容器能保持压强恒定:

 NaOH溶液中,完全反应后溶液中离子浓度由大到小的顺序是____________________。
NaOH溶液中,完全反应后溶液中离子浓度由大到小的顺序是____________________。