17.1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
(1)画出周期表中电负性最大的元素原子的轨道式
估计钙元素的电负性的取值范围:__ __<X<___ _。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值
大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。
试推断AlBr3中形成的化学键的类型为______,其理由是______ _______。
答案:(1)F 0.8<X<1.2 (2)从上向下X值减小 元素电负性越大,非金属性越强,金属越弱;反之亦然 (3)共价键 因为AlCl3中Cl和Al的电负性差值为1.5,而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值小于1.5
16.已知Br2、Fe2(SO4)3、CaC2等物质均能与水发生反应,生成两种物质。下表中所列四种物质都易与水反应。
(1)在表中空格处填写各物质分别与水反应的产物中,属于氧化物对应水化物的化学式:
|
Li3N |
NaNH2 |
SiBr4 |
Mg2Si |
|
|
|
|
|
(2)写出这四种物质与水反应的产物中,溶于水形成无氧酸的物质的电子式
(3)由氨水和次氯酸盐溶液在弱碱性介质中反应可生成氯胺H2NCl,分子结构类似于NH3,H2NCl分子的空间构型为__________________,电子式为_________________
(1)LiOH、、NaOH、H4SiO4(或H2SiO3)、Mg (OH)2
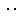
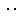
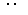
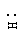
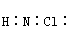 (2)
(2)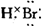
(3)三角锥形 +1
14.元素处于基态时的气态原子获得一个电子成为-1价阴离子时所放出的能量叫做该元素的第一电子亲合能。-1价阴离子再获得一个电子的能量变化叫做第二电子亲合能。下表中给出了几种元素或离子的电子亲合能数据;:
|
元素 |
Li |
Na |
K |
O |
O- |
F |
|
电子亲合能/kJ·mol-1 |
59.8 |
52.7 |
48.4 |
141 |
-780 |
327.9 |
下列说法正确的是
A.电子亲合能越大,说明越难得到电子
B.一个基态的气态氟原子得到一个电子成为氟离子时放出327.9kJ的能量
C.氧元素的第二电子亲合能是-780kJ·mol-1
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量