9.已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0_5 |
4.9×l0_10 |
K1=4.3×l0_7 K2=5.6×l0_11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中
c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
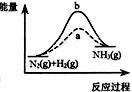
7.在温度、容积相同的3个密闭容器中,按不同方式 投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)
投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g) 2NH3(g)
⊿H=-92.4kJ·mol-1)
2NH3(g)
⊿H=-92.4kJ·mol-1)
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1molN2 、3molH2 |
2mol NH3 |
4mol NH3 |
|
NH3的浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
反应物转化率 |
α 1 |
α 2 |
α 3 |
下列说法正确的是A. 2c1 > c3 B. a + b = 92.4 C. 2p2 < p3 D. α1 + α3 < 1
 C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: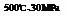 N2(g)+3H2(g)
N2(g)+3H2(g) 2NH3(g)
△H=-38.6kJ·mol-1
2NH3(g)
△H=-38.6kJ·mol-1 xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是