27、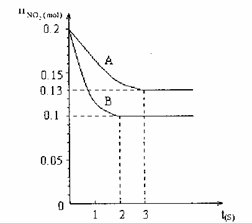 在容积为VL的密闭容器中发生反应:2NO2
在容积为VL的密闭容器中发生反应:2NO2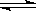 2NO+O2。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2。反应过程中NO2的物质的量随时间变化的状况如图所示。
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是
A.有、无催化剂 B.温度不同
C.压强不同 D.V值不同
(2)写出该反应的化学平衡常数K的表达式:
,
并比较K800℃ K850℃(填“>”、“<”或“=”)。
(3)在图上作出在A条件下NO的变化曲线,并求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)= 。
(4)不能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO) B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(5)在如图所示的三个容积相同的三个容器①、②、③进行反应:2NO+O2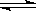 2NO2
2NO2
 |
|||||||||||
 |
 |
||||||||||
|
|||||||||||
|
|||||||||||
|
|||||||||||
(Ⅰ)若起始温度相同,分别向三个容器中充入2molNO和1molO2 ,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号) 。 (Ⅱ)若起始时维持温度和体积不变,②中投入2molNO和1molO2; ③中投入2molNO和1molO2和2molNO2,则达到平衡时,两容器中NO的转化率② ③。(填“<”、“>”或“=”) 28、25℃时,0.1mol·L-1HA溶液pH=2,0.1mol·L-1HB溶液pH=3;
(1)前者大于后者的是 (多选、错选均不给分,下同)
① HA、HB的电离平衡常数 ② HA、HB的电离度 ③ 溶液中的c(OH-)
④溶液的导电性 ⑤ 溶液中由水电离出的c(H+)
(2)若HA、HB溶液的pH相同、体积相等,前者大于后者的是
①HA、HB物质的量浓度 ②同时加入足量的锌,开始反应时速率 ③同时加入足量的锌,反应完全后生成H2的质量 ④二种酸溶液的导电能力 ⑤用1mol/LNaOH溶液分别中和二种酸,消耗NaOH溶液体积 ⑥将这两种溶液分别稀释10倍后溶液的pH。 (3)若中和体积为Va mL浓度为0.1mol·L-1 HA溶液,消耗0.1mol·L-1NaOH溶液的体积为Vb mL,则Va>Vb可能的是
①混合后溶液呈中性 ②混合后溶液呈酸性 ③混合后溶液中的溶质为NaA
④混合后溶液中的溶质为NaA和HA ⑤混合后溶液中的溶质为NaA和NaOH。
(4)对于浓度相同体积相等的的NaA、NaB溶液相比较,前者大于后者的是
①溶液的pH ②溶液中由水电离出的c(OH-) ③离子种类 ④阴离子总数 ⑤离子总数
(5)25℃时,如果取一定量HA溶液与含0.1molNaOH的溶液混合,有关离子浓度判断不可能出现的结果是
① c(A-)+c(HA)=0.1mol/L ② c(H+)+c(Na+)=c(A-)+c(OH-)
③ c(A-)>c(Na+)> c(H+)>c(OH-) ④ c(Na+)> c(A-)> c(OH-) > c(H+)
⑤ c(A-)> c(H+) > c(Na+) >c(OH-) ⑥ c(Na+)> c(OH-)>c(H+)> c(A-)
(6)25℃时,用0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合,测得混合后溶液pH=10, 则混合溶液中:c(HA) c(A-)(填“<”、“>”、“=”);c(Na+)-c(A-)= mol·L-1;(用具体数字填计算结果,下同)c(OH-)-c(HA)= mol·L-1
 pC(g);△H<0中m、n、p为系数,且m+n>p。分析下列各图,在平衡体系中A的质量分数与温度t℃、压强P关系正确的是
pC(g);△H<0中m、n、p为系数,且m+n>p。分析下列各图,在平衡体系中A的质量分数与温度t℃、压强P关系正确的是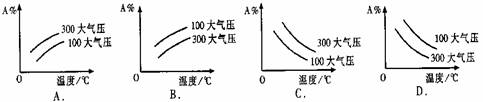
 一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,总反应式为:2C2H6+7O2+8KOH 4K2CO3+10H2O,下列推断正确的是
一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,总反应式为:2C2H6+7O2+8KOH 4K2CO3+10H2O,下列推断正确的是 A.负极反应为7O2+14 H2O+28e- 28OH-
A.负极反应为7O2+14 H2O+28e- 28OH- 2C(气)。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
2C(气)。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是 2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5molO2,当它们分别达到平衡时放出的热量为Q1KJ和Q2KJ,则下列比较正确的是
2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5molO2,当它们分别达到平衡时放出的热量为Q1KJ和Q2KJ,则下列比较正确的是