摘要:28.某校化学兴趣小组参观制碱厂后.获得以下信息并对相关问题进行研究. [查阅资料] <资料1> 该厂采用“侯氏制碱法 生产的化工产品为纯碱和氯化铵.(“侯氏制碱法 是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.) <资料2> 生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质. <资料3> 部分生产流程如下图所示. 上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH= ▲ ↓+2NaCl, Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl,NH4Cl== NH3↑+HCl↑ <资料4>生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵 的混合物.其反应的化学方程式为:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl,分 离出固体产物.使其充分受热即可分解制得纯碱及两种常见的氧化物.此反应的化学方 程式为 ▲ . [问题讨论] (1)溶液A中的溶质为 ▲ .操作Ⅱ的名称为 ▲ . (2)上述生产流程中可循环使用的是 ▲ . A. CO2 B. NH3 C. HCl D.NaOH E. Na2CO3 (3)根据上述信息.请你设计实验区分碳酸钠和碳酸氢钠. 实验步骤 实验现象 实验结论 ▲ ▲ ▲ [含量测定] 研究小组的同学们为了测定该纯碱样品的纯度.设计了如下实验. 甲组: 取10.0 g纯碱样品(假定杂质在整个实验过程中不发生变化).向其中加入过量的盐酸. 直至样品中无气泡冒出.充分加热蒸发所得物质并 干燥.冷却至室温后称量.所得固体质量为10.9 g. 样品中碳酸钠的质量分数为 ▲ (结果保留一 位小数). 乙组: 取10.0 g纯碱样品.利用右图所示装置.测出反应 后装置C增重了3.5 g.实验结束后.发现乙组测定的质量分数偏小. 其原因是 ▲ . 2011届中考复习调研性检测试卷(一)
网址:http://m.1010jiajiao.com/timu3_id_31490[举报]
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【产品与原理】
该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【生产流程】
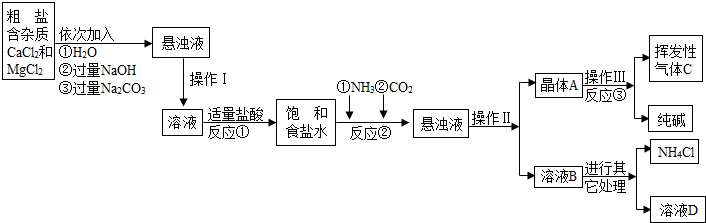
【相关资料】
(1)NH4Cl
NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如下
(气体指1体积水中能溶解的气体体积)
【问题讨论】:
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为 .
(2)反应①中发生了两个反应,写出其中的一个化学方程式:
.
(3)反应③中得到纯碱的化学方程式为: .
(4)溶液B中的溶质有 (至少写出两种).
(5)上述生产流程中可循环使用的是 (填序号).
A.挥发性气体C; B.溶液D; C.氢氧化镁;D.化肥NH4Cl
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质 (写化学式).
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,
请通过计算并结合右表判断此纯碱样品等级为 品.
【计算过程】
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 .
查看习题详情和答案>>
【产品与原理】
该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【生产流程】

【相关资料】
(1)NH4Cl
| ||
(2)已知20℃时有关物质的溶解度如下
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
【问题讨论】:
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为
(2)反应①中发生了两个反应,写出其中的一个化学方程式:
(3)反应③中得到纯碱的化学方程式为:
(4)溶液B中的溶质有
(5)上述生产流程中可循环使用的是
A.挥发性气体C; B.溶液D; C.氢氧化镁;D.化肥NH4Cl
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,
请通过计算并结合右表判断此纯碱样品等级为
【计算过程】
| 工业纯碱标准:(Na2CO3≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
[查阅资料]
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱(化学式为 )和氯化铵.
(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示.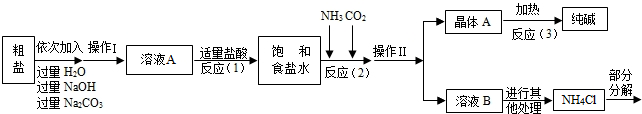
上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
Na2CO3+CaCl2=CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(晶体)↓+NH4Cl;分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为 .
【问题讨论】
(1)溶液A中的溶质为 ,操作Ⅱ的名称为 .
(2)上述生产流程中可循环使用的是 (填序号).
A.CO2B.NH3C.HCl D.NaOH E.Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
【含量测定】
同学们为了测定该纯碱样品的纯度,设计了如下实验.
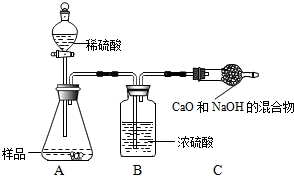
甲组:取10.0g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为 (结果保留一位小数).
乙组:取10.0g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是 .
查看习题详情和答案>>
[查阅资料]
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱(化学式为
(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示.

上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
Na2CO3+CaCl2=CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(晶体)↓+NH4Cl;分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为
【问题讨论】
(1)溶液A中的溶质为
(2)上述生产流程中可循环使用的是
A.CO2B.NH3C.HCl D.NaOH E.Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
| 实验步骤 | 实验现象 | 实验结论 |
同学们为了测定该纯碱样品的纯度,设计了如下实验.

甲组:取10.0g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为
乙组:取10.0g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
查阅资料:
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵.
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示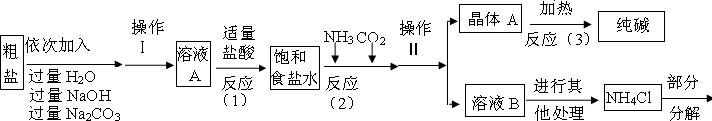
氯化铵分解的化学方程式是NH4Cl═NH3↑+HCl↑
<资料4>生产原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,分离的晶体A,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为 .
问题讨论:
(1)溶液A中的溶质为 ,操作Ⅱ的名称为 .
(2)上述流程中氢氧化钠溶液的作用是 ,碳酸钠溶液的作用是
(3)上述生产流程中可循环使用的是 (填序号).
A.CO2 B.NH3 C.HCl D.NaOH E.Na2CO3
(4)上述反应(1)中发生了两个化学反应,写出反应的化学方程式: ,
组成确定:
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质 (写化学式).
含量测定:
同学们为了测定该纯碱样品的纯度(假定只含一种上述杂质),设计了如下实验.
甲组:取12,0g纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出.将反应后所得溶液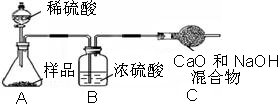 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为 (必须要有写出计算过程,请在下方写出)
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为 (必须要有写出计算过程,请在下方写出)
乙组:取12,0g纯碱样品,利用右图所示装置,测出反应后装置C增重了4.1g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是 .
丙组:取12.0克的纯碱样品,完全溶于水,向其中加入过量的氯化钙溶液,待完全沉淀后过滤、洗涤、烘干称量固体质量,从而计算碳酸钠的质量分数.组内同学提出意见,认为如果将氯化钙溶液换成氯化钡溶液则更好,老师认为有道理,原因是 .
查看习题详情和答案>>
查阅资料:
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵.
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示

氯化铵分解的化学方程式是NH4Cl═NH3↑+HCl↑
<资料4>生产原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,分离的晶体A,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为
问题讨论:
(1)溶液A中的溶质为
(2)上述流程中氢氧化钠溶液的作用是
(3)上述生产流程中可循环使用的是
A.CO2 B.NH3 C.HCl D.NaOH E.Na2CO3
(4)上述反应(1)中发生了两个化学反应,写出反应的化学方程式:
组成确定:
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质
含量测定:
同学们为了测定该纯碱样品的纯度(假定只含一种上述杂质),设计了如下实验.
甲组:取12,0g纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出.将反应后所得溶液
 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为乙组:取12,0g纯碱样品,利用右图所示装置,测出反应后装置C增重了4.1g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是
丙组:取12.0克的纯碱样品,完全溶于水,向其中加入过量的氯化钙溶液,待完全沉淀后过滤、洗涤、烘干称量固体质量,从而计算碳酸钠的质量分数.组内同学提出意见,认为如果将氯化钙溶液换成氯化钡溶液则更好,老师认为有道理,原因是
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
产品与原理:
该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应的化学方程式为: ;分离出NaHCO3,加热制得纯碱.
生产流程: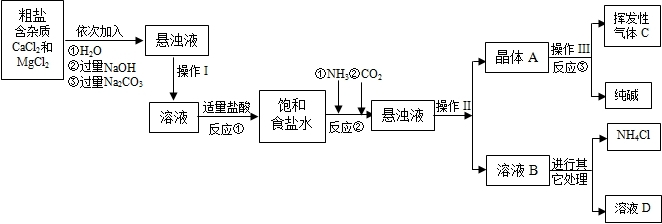
相关资料:
(1)NH4Cl
NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
问题讨论:
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为 .
(2)反应①中发生了两个反应,写出这两个化学方程式:① ;② .
(3)反应③中得到纯碱的化学方程式为: .
(4)溶液B中的溶质有 (至少写出两种).
(5)上述生产流程中可循环使用的是 (填序号).
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
(6)检验挥发性气体C的方法 .
组成确定:
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质 (写化学式).
含量测定:
工业纯碱标准:(Na2CO3%≥)优等品一等品合格品99.298.898.0
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算并结合右表判断此纯碱样品等级为 品.
计算过程:
总结反思:
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 .
查看习题详情和答案>>
产品与原理:
该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应的化学方程式为:
生产流程:

相关资料:
(1)NH4Cl
| ||
(2)已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为
(2)反应①中发生了两个反应,写出这两个化学方程式:①
(3)反应③中得到纯碱的化学方程式为:
(4)溶液B中的溶质有
(5)上述生产流程中可循环使用的是
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
(6)检验挥发性气体C的方法
组成确定:
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质
含量测定:
工业纯碱标准:(Na2CO3%≥)优等品一等品合格品99.298.898.0
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算并结合右表判断此纯碱样品等级为
计算过程:
总结反思:
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【产品与原理】该厂采用“侯氏制碱法”生产化工产品--纯碱和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【生产流程】
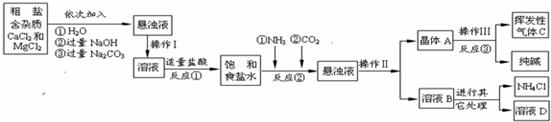
【相关资料】(1)NH4Cl═NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
【问题讨论】
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为
(2)反应①中发生了两个反应,写出其中的一个化学方程式:
(3)溶液B中的溶质有
(4)上述生产流程中可循环使用的是
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算并结合右表判断此纯碱样品等级为
计算过程:
【总结反思】某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是
查看习题详情和答案>>
【产品与原理】该厂采用“侯氏制碱法”生产化工产品--纯碱和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【生产流程】

【相关资料】(1)NH4Cl═NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710g | 0.9g |
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为
过滤
过滤
.(2)反应①中发生了两个反应,写出其中的一个化学方程式:
NaOH+HCl═NaCl+H2O或Na2CO3+2HCl═2NaCl+H2O+CO2↑;
NaOH+HCl═NaCl+H2O或Na2CO3+2HCl═2NaCl+H2O+CO2↑;
.(3)溶液B中的溶质有
NaHCO3、NaCl、NH4Cl、NH4HCO3四种任选两种
NaHCO3、NaCl、NH4Cl、NH4HCO3四种任选两种
(至少写出两种).(4)上述生产流程中可循环使用的是
AB
AB
(填序号).A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
【含量测定】
| 工业纯碱标准:(Na2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
合格
合格
品.计算过程:
98.1%
98.1%
(计算结果保留一位小数)【总结反思】某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是
等质量的碳酸钠与氯化钡反应产生的碳酸钡沉淀质量大,所以称量时的(相对)误差较小.
等质量的碳酸钠与氯化钡反应产生的碳酸钡沉淀质量大,所以称量时的(相对)误差较小.
.