28.(9分)A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2。C、D的电离能数据如下(kJ·mol―1):
|
|
I1 |
I2 |
I3 |
I4 |
|
C |
738 |
1451 |
7733 |
10540 |
|
D |
577 |
1817 |
2745 |
11578 |
(1)化合价是元素的一种性质。由C、D的电离能数据判断,C通常显 价,D显 价;
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含___个σ键,___个π键;
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是_________________________________________________________________
______________________________________________________________________________
|
|
单键 |
双键 |
叁键 |
|
|
AB |
键能(kJ·mol―1) |
357.7 |
798.9 |
1071.9 |
|
甲 |
键能(kJ·mol―1) |
154.8 |
418.4 |
941.7 |
(4)E能与AB形成配合物,其中E提供______________,AB提供________________。
(5)下列晶胞中,阳离子与阴离子的个数为
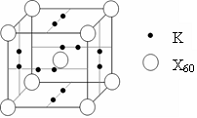
26.(10分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
|
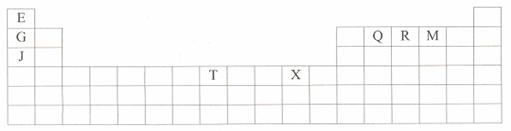
(1)X原子的价电子排布式是:______________________________________;
(2)M元素在周期表中的位置是第______周期第_______族;¥高#考#资%源*网
(3)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示);
(4)E与Q所形成的化合物含 键,属 分子。(填“极性”或“非极性”)
(5)Fe2+与Mn2+两种离子,________更容易再失去1个电子,原因是_______________________
_______________________________________________________________________________。
(6)用氢键表示式写出W的氢化物溶液中存在的所有氢键___________________ ___。
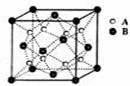 某离子晶体的晶体结构中最小重复单元如右图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为 (
)
某离子晶体的晶体结构中最小重复单元如右图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为 (
)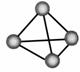 以共价单键相连的非金属单质中,1个原子与相邻原子成键的数目为(8-N)个,N为该非金属元素的族序数,这一现象被化学家称为8-N规则。某非金属单质的结构如右图所示,构成该单质的元素位于
( )
A.第ⅢA族
B.第ⅣA族
C.第ⅤA族
D.第ⅥA族
以共价单键相连的非金属单质中,1个原子与相邻原子成键的数目为(8-N)个,N为该非金属元素的族序数,这一现象被化学家称为8-N规则。某非金属单质的结构如右图所示,构成该单质的元素位于
( )
A.第ⅢA族
B.第ⅣA族
C.第ⅤA族
D.第ⅥA族