1.下列物质分类组合正确的是 ( )
|
|
A |
B |
C |
D |
|
强电解质 |
HCl |
FeCl3 |
H3PO4 |
Ca(OH)2 |
|
弱电解质 |
HF |
HCOOH |
BaSO4 |
HCl |
|
非电解质 |
NH3 |
Cu |
H2O |
C2H5OH |
25、(14分)我国规定饮用水质量标准必须符合下表所示要求:
|
项目 |
pH |
Ca2+、Mg2+总浓度 |
细菌个数 |
|
相关值 |
6.5-8.5 |
<0.0045mol·L-1 |
<100个·mL-1 |
下图是源水处理成自来水的工艺流程示意图。
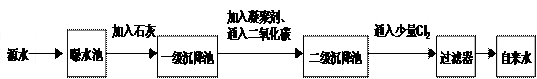
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,在一级沉降池中所得沉淀的主要成分为 和 ( 写化学式 )。
(2)FeSO4·7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀。凝聚剂除去悬浮固体颗粒的过程 __________(填写编号)。
①只是物理过程; ②只是化学过程; ③是物理和化学过程。
(3)通入二氧化碳的目的是 和调节pH值。
(4)Cl2的作用是 ,这种作用是基于Cl2和水反应的产物具有 性,Cl2与水反应的化学方程式为
(5)下列物质中, 可以作为气体Cl2的代用品。(填写编号,多选倒扣)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
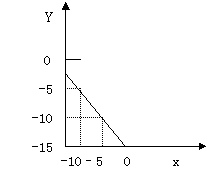 (1) 求该温度下,中性溶液的pH。
(1) 求该温度下,中性溶液的pH。
 Mg2+ +2OH-
Mg2+ +2OH- 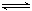 3C(g)+2D(g),
3C(g)+2D(g),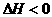 ;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题: