24.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)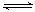 2NH3(g) △H=-92.6 kJ/moL。实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=-92.6 kJ/moL。实验测得起始、平衡时的有关数据如下表:
|
容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
|
N2 |
H2 |
NH3 |
||
|
① |
1 |
3 |
0 |
放出热量:23.15kJ |
|
② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ,
18.(10分)可逆反应C(固)+H2O(气) CO(气)+H2(气)正反应放热。 在一定条件下达到平衡,改变下列条件,正、逆反应速率各怎样变化?化学平衡怎样移动?
CO(气)+H2(气)正反应放热。 在一定条件下达到平衡,改变下列条件,正、逆反应速率各怎样变化?化学平衡怎样移动?
投入焦炭粉末;(2)增加CO;(3)降温;(4)加压;(5)使用催化剂
(反应速率填增大,减小或不变;平衡移动方向填正反应方向,逆反应方向或不移动)
|
|
(1) |
(2) |
(3) |
(4) |
(5) |
|
逆反应速率 |
|
|
|
|
|
|
平衡移动方向 |
|
|
|
|
|
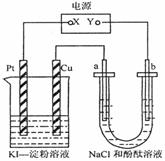 2Cu2++4I-==2CuI↓+I2而得到。如图所示装置中,a、b都是
2Cu2++4I-==2CuI↓+I2而得到。如图所示装置中,a、b都是 
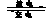 Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是 A.
A. N2(g)+
N2(g)+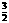 H2(g) =NH3(g);
H2(g) =NH3(g); 2NH3(g) ;在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。
2NH3(g) ;在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。