29.(10分)科学家一直致力于“人工固氮”的新方法研究。
(1)目前合成氨技术原理为:N2(g) + 3H2(g) 2NH3(g);△H= - 92.4kJ·mol-1。
2NH3(g);△H= - 92.4kJ·mol-1。
①673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时
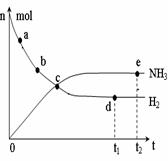 间变化的关系如右图所示。下列叙述正确的是____。
间变化的关系如右图所示。下列叙述正确的是____。
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d和点 e处的n(N2)相同高*考*资*源*网
D.773K,30MPa下, t2时刻也是该反应的平衡点,则n(NH3)比图中e点的值大
 ②在容积为2.0 L恒容的密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),反应在673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下反应N2(g) + 3H2(g)
②在容积为2.0 L恒容的密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),反应在673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下反应N2(g) + 3H2(g)
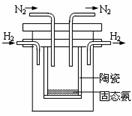
 2NH3(g)的平衡常数K= ______________。(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY
2NH3(g)的平衡常数K= ______________。(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY
陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验
装置如图。阴极的电极反应式 。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2
在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1)  2NH3(g) +
2NH3(g) + 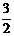 O2(g)。△H = a kJ·mol-1高*考*资*源*网
O2(g)。△H = a kJ·mol-1高*考*资*源*网
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的ΔS______0,(填“>”、“<”或“=”)
②已知:N2(g)
+ 3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol-1高*考*资*源*网
2NH3(g) ΔH= -92 .4kJ·mol-1高*考*资*源*网
2H2(g) + O2(g) = 2H2O(l) ΔH = --571.6kJ·mol-1
则N2(g) + 3H2O(1) = 2NH3(g)
+ 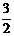 O2(g) ΔH= __________kJ·mol-1 。
O2(g) ΔH= __________kJ·mol-1 。
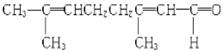 法不正确的是( )
法不正确的是( )