3.氯化钠在自然界的存在
海水、盐湖、盐井和盐矿中都蕴藏着氯化钠。用海水晒盐或用井水、盐湖水煮盐,都可以使水分蒸发,使食盐溶液得到饱和,再继续蒸发就可以析出食盐晶体,这样得到的食盐含有较多杂质,叫做粗盐。要想得到纯净的食盐,需要提纯。
活动与探究:
实验原理:将粗盐溶解,过滤除去不溶物,再将滤液蒸发结晶。
实验仪器:量筒、托盘天平、小烧杯、药匙、胶头滴管、玻璃棒、酒精灯、铁架台、蒸发皿、滤纸。
实验药品:蒸馏水、粗盐。
实验装置:如下图。

实验过程:
|
步骤 |
现象 |
结论 |
|
(1)溶解:量取10 mL蒸馏水倒入烧杯,用天平称取5.0 g粗盐加入烧杯中,充分搅拌 |
烧杯中得到浑浊的液体 |
通过溶解、过滤、 蒸发等操作,可 除去粗盐中不溶性杂质 |
|
(2)过滤:制作好过滤器,将烧杯中浑浊的液体沿着玻璃棒慢慢倒入漏斗 |
滤液变澄清, 滤纸上有大量泥沙等 |
|
|
(3)蒸发:将滤液倒入蒸发皿中,用酒精灯加热,并不断用玻璃棒搅拌,当出现多量固体时停止加热,利用余热把食盐烘干 |
蒸发皿中出现大 量白色物质 |
|
|
(4)计算产率:用玻璃棒把固体转移到纸上,称量后,倒入指定容器,计算产率 |
所得食盐的质量 比粗盐少 |
实验说明:1.过滤操作的要点是一贴、二低、三靠。
一贴:滤纸要紧贴在漏斗内壁上,中间不要留有气泡;
二低:液面低于滤纸边缘,滤纸边缘低于漏斗边缘;
三靠:玻璃棒要紧靠漏斗中三层滤纸处,盛混合液的烧杯口要紧靠在玻璃棒上,漏斗的末端要紧靠在盛接滤液的烧杯内壁上。

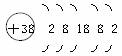 ?
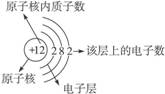
?
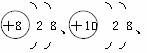
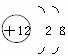 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( ) 。小红对它的认识中错误的是( )
。小红对它的认识中错误的是( )