5.下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=10-7mol·L-1的溶液
C.c(H+)/c(OH-)=10-14溶液 D.氨水和氯化铵的混合液中c(NH4+)=c(Cl-)
15.(10分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得资料如下:①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te
③氧气、硫、硒、碲与1mol H2反应的焓变情况如下表所示。
|
物质 |
O2 |
S |
Se |
Te |
|
△H(kj·mol-1) |
-242 |
-20 |
81 |
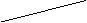 |
请回答下列问题:
(1)写出硒化氢发生反应的热化学方程式:
。
(2)已知298K时,H2Te分解反应的△S>0,△H=-154kj·mol-1,请解释Te和H2
不能直接化合的原因
。
(3)H2S的水溶液显弱酸性,写出其电离方程式 ;它的第一级电离常数可用Kal来表示,当温度升高时,Kal的值 (填“一定增大”、“一定减小”或“不能确定”)。
 16.(10分)向某一容积为1L的密闭容器中加入1molCO和1molH2O,在800℃条件下发生了反应CO (g) + H2O (g) CO 2
(g) + H2 (g),△H < 0
16.(10分)向某一容积为1L的密闭容器中加入1molCO和1molH2O,在800℃条件下发生了反应CO (g) + H2O (g) CO 2
(g) + H2 (g),△H < 0
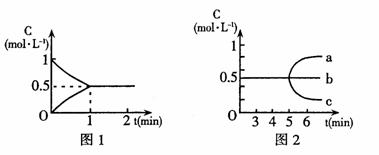 反应中各物质的浓度随时间而变化的情况如图
反应中各物质的浓度随时间而变化的情况如图
(1)该反应在800℃时的平衡常数为 。
(2)根据图1中数据知,反应开始至达到平衡时的平均反应速度v(CO)为 。
(3)反应达到平衡后,第5分钟时,(用图2中a~c编号回答)
①若降低温度,H2浓度变化正确的是
②若加入水蒸气,CO浓度变化正确的是
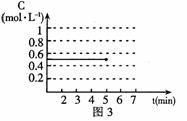 (4)反应达到平衡后,第5分钟时,将反应容器的容积压缩到原来的
(4)反应达到平衡后,第5分钟时,将反应容器的容积压缩到原来的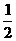 ,请在图3中画出5分钟后CO2浓度的变化情况。
,请在图3中画出5分钟后CO2浓度的变化情况。
 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是( )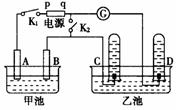 (18分)在右图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g。
(18分)在右图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g。 ②假设二:
。
②假设二:
。 (3)已知水存在如下平衡,H2O+H2O H3+O+OH-;△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
.
(3)已知水存在如下平衡,H2O+H2O H3+O+OH-;△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
.