0 29037 29045 29051 29055 29061 29063 29067 29073 29075 29081 29087 29091 29093 29097 29103 29105 29111 29115 29117 29121 29123 29127 29129 29131 29132 29133 29135 29136 29137 29139 29141 29145 29147 29151 29153 29157 29163 29165 29171 29175 29177 29181 29187 29193 29195 29201 29205 29207 29213 29217 29223 29231 447348
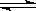 O2+Hb·CO
O2+Hb·CO (4分)已知难溶于水的盐在水中存在溶解平衡:AgCl(s)
(4分)已知难溶于水的盐在水中存在溶解平衡:AgCl(s) Ag++Cl-
Ag++Cl-  (10分)为了在中学化学实验室验证某酸HA的酸性弱于盐酸。甲、乙、丙三位同学设计了如下方案:
(10分)为了在中学化学实验室验证某酸HA的酸性弱于盐酸。甲、乙、丙三位同学设计了如下方案: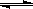 H3O++OH-; △H>0kJ·mol-1现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是___________(填编号)
H3O++OH-; △H>0kJ·mol-1现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是___________(填编号)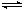 将8mlSO2与O2的混合气体在催化剂作用下发生反应2SO2(g) + O2(g) 2SO3(g),达到平衡后在相同条件下混合气体的体积变为6ml。则在原混合气体中SO2与O2的体积比可能是
( )
将8mlSO2与O2的混合气体在催化剂作用下发生反应2SO2(g) + O2(g) 2SO3(g),达到平衡后在相同条件下混合气体的体积变为6ml。则在原混合气体中SO2与O2的体积比可能是
( ) A.以NaCl溶液或NaOH溶液为电解液时,正极反应不同
A.以NaCl溶液或NaOH溶液为电解液时,正极反应不同