0 29054 29062 29068 29072 29078 29080 29084 29090 29092 29098 29104 29108 29110 29114 29120 29122 29128 29132 29134 29138 29140 29144 29146 29148 29149 29150 29152 29153 29154 29156 29158 29162 29164 29168 29170 29174 29180 29182 29188 29192 29194 29198 29204 29210 29212 29218 29222 29224 29230 29234 29240 29248 447348
 ④
④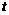 ℃)时,测得
℃)时,测得 的NaOH溶液的pH为11,则该温度下水的
的NaOH溶液的pH为11,则该温度下水的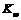 =
。则该温度(选填大于、小于或等于)
25℃,
=
。则该温度(选填大于、小于或等于)
25℃,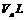 与pH=b的
与pH=b的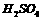 溶液
溶液 混合,通过计算填写以下不同情况时两溶液的体积比:
混合,通过计算填写以下不同情况时两溶液的体积比: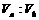 =
;
=
; 2SO3(g);△H<0
2SO3(g);△H<0 (1)写出该反应的化学平衡常数表达式
(1)写出该反应的化学平衡常数表达式 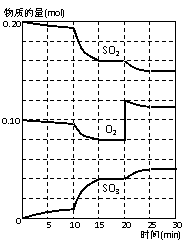 ③如果加0.01mol/L HCl,应加
mL。
③如果加0.01mol/L HCl,应加
mL。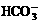 )+c(
)+c(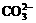 )+c(H2CO3)
)+c(H2CO3) 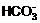

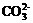 +H+。
+H+。 2Z反应
2Z反应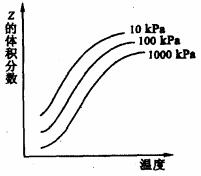 B
0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液
B
0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液