16.(6分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式________________________________________。
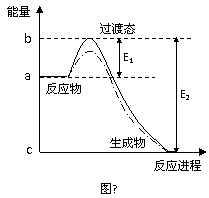
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
|
化学键 |
H-H |
N-H |
N≡N |
|
键能/kJ·mol-1 |
436 |
391 |
945 |

 已知反应N2+3H2 NH3 △H=a
kJ·mol-1。试根据表中所列键能数据估算a的数值为________________。
已知反应N2+3H2 NH3 △H=a
kJ·mol-1。试根据表中所列键能数据估算a的数值为________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+02(g)=C02(g) △H1=-393.5kJ·mol-1
2H2(g)+02(g)=2H20(l) △H2=-571.6kJ·mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变 :
△H=______________________________________。
17(13分).甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:
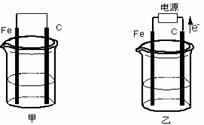
(1)若两池中均为硫酸铜溶液,反应一段时间后:
1有红色物质析出的是甲池中的__________________棒,乙池中的_______________ 棒
2乙池中阳极的电极反应式是__________________
(2)若两池中均为饱和NaCl溶液:
1写出乙池中总反应的离子方程式__________________
2甲池中碳极上电极反应式是____________________________________
乙池碳极上电极反应属于__________________ (填“氧化反应”或“还原反应”)
3若乙池转移0.02mol电子后停止试验,池中溶液体积是200ml,则溶液混均后的C(OH-)=_________(不考虑电解产物的相互反应)
4电解之前食盐水需要精制,目的是除去粗盐中的Ca2+,Mg2+,SO42-等杂质离子,使用试剂有:
a. Na2CO3溶液,b. Ba(OH)2溶液,c. HCl溶液 其合理加入顺序为(试剂填序号)_________
 2NH3(g)
△H<0。
2NH3(g)
△H<0。
 (14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。
(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。 2LiH
2LiH
 已知铅蓄电池总反应:
已知铅蓄电池总反应: 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH
+ 3O2 + 4OH- 2CO32- + 6H2O,则下列说法错误的是 ( )
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH
+ 3O2 + 4OH- 2CO32- + 6H2O,则下列说法错误的是 ( )