23.(8分)(1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol•L-1的盐酸30.00mL恰好中和完全(如图所示)。试回答:
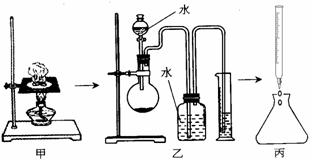
①甲、乙、丙三套装置共有________处错误;
②丙操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是 ;
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及质量填在下表(表格可不填满也可补充):
|
成 分 |
|
|
|
|
质量/g |
|
|
|
(2)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度_____(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____(填“难”、“易”)溶的缘故。
镇江市2008-2009六校教学质量调研
高二化学评分标准
19.(8分) 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
催化剂-铁触媒,温度-400-500℃,压强-30-50MPa。
回答下列问题:
⑴合成氨工业中原料气压缩到30-50MPa的原因是 ,从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400-500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 ;
⑵500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= ;
⑶甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式 ;
⑷有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式 。
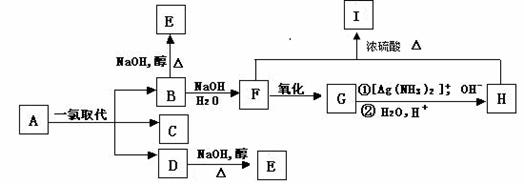
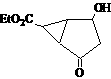
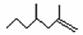 (2,4-二甲基-1-庚烯) ,
(2,4-二甲基-1-庚烯) , 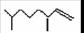 (3,7-二甲基-1-辛
(3,7-二甲基-1-辛 烯),家蚕的性信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。试完成下列问题:
烯),家蚕的性信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。试完成下列问题: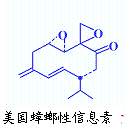 ⑵烯烃A是2,4-二甲基-1-庚烯的一种同分异构体,A与足量氢气加成得到烷烃B,B的一氯代物只有2种;烯烃C是3,7-二甲基-1-辛烯的一种同分异构体,C与氢气加成得到烷烃D,D的一氯代物也只有2种,则:
⑵烯烃A是2,4-二甲基-1-庚烯的一种同分异构体,A与足量氢气加成得到烷烃B,B的一氯代物只有2种;烯烃C是3,7-二甲基-1-辛烯的一种同分异构体,C与氢气加成得到烷烃D,D的一氯代物也只有2种,则: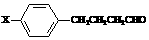 ,X可能的结构有
种。
,X可能的结构有
种。
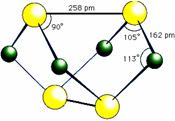
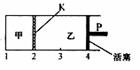 一定温度下可逆反应:A(s)+2B(g)
一定温度下可逆反应:A(s)+2B(g) C(g)+D(g)
△H<0。现将1mol A和 2molB加入甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
C(g)+D(g)
△H<0。现将1mol A和 2molB加入甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是