12.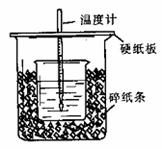 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
 该用品能否用铁质用品代替 ,原因是①
②
该用品能否用铁质用品代替 ,原因是①
②
(2)图示中用品填加后的装置叫 。
(3)烧杯间填满碎纸条的作用是 。
(4)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”)。
已知在稀溶液中强酸与强碱发生中和反应生成1mol水时放出57.3kj的热量,写出上述反应的热化学方程式
(6)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(7)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值
(填偏高、偏低或不变);
(8)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
|
实验序号 |
起始温度t1/℃ |
终止温度(t2)℃ |
温差(t2-t1)℃ |
||
|
盐酸 |
NaOH溶液 |
平均值 |
|||
|
1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
|
2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
|
3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C = 4.18 J (g.·℃)则该反应的中和热为△H=______________;
______年______月______日 星期_______
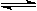 2B中,A.B的浓度变化如图所示。则2min以内的平均反应速率为
2B中,A.B的浓度变化如图所示。则2min以内的平均反应速率为 A.v(A) = 9
mol/(L·min) B.v(A) = 4.5 mol/(L·min)
A.v(A) = 9
mol/(L·min) B.v(A) = 4.5 mol/(L·min)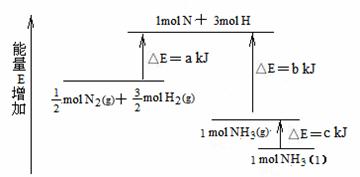
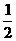 N2(g)+
N2(g)+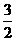 H2(g) = NH3(l) ;⊿H = (b+c-a)kJ·mol-1
H2(g) = NH3(l) ;⊿H = (b+c-a)kJ·mol-1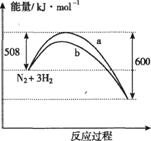
 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1  2CO(g);2CO(g) + O2(g)
2CO(g);2CO(g) + O2(g)