9.(2007年高考海南化学卷,反应速率)(9分)下表是稀硫酸与某金属反应的实验数据:
|
实验 序号 |
金属质量 /g |
金属 状态 |
c(H2SO4)/mol·L-1 |
V(H2SO4)/mL |
溶液温度/℃ |
金属消失 的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,________________________ 对反应速率有影响,________________反应速率越快,能表明同一规律的实验还有_________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有__________________________(填实验序号);
(3)本实验中影响反应速率的其他因素还有_____________________,其实验序号是___________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:________________________________
______________________________________________________。
8. (2007年高考广东化学卷,化学速率) (8分)“碘钟”实验中,3I-+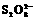 =I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
=I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/ mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
c(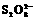 )/mol·L-1 )/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是___________________________________________________。
(2)显色时间t1=______________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。
(A)<22.0 s (B)22.0 s-44.0 s (C)>44.0 s (D)数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_________________________________________。
 2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是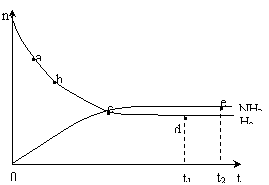

 Z(g)
Z(g) 2SO3(g)能增大正反应速率的措施是
2SO3(g)能增大正反应速率的措施是