34.(6分)某温度下SO2的转化反应的平衡常数K =532.4,2SO2+O2  2SO3
2SO3
下面三个混合体系中各物质的浓度如下表:
|
体系 |
c(SO2) mol/L |
c(O2) mol/L |
c(SO3) mol/L |
反应方向 |
|
(1) |
0.0600 |
0.400 |
2.000 |
|
|
(2) |
0.0960 |
0.300 |
0.500 |
|
|
(3) |
0.0862 |
0.263 |
1.020 |
|
试判断各体系中反应进行的方向:
体系(1)
体系(2)
体系(3) 。
化学选修测试题(2006-11-08)参考作案
30.(10分)
(1) (3分) 下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)==CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)==Ca(OH)2(s);△H8
(2) (3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
(3) (4分)有些盐的结晶水合物,白天在温度不太高时就能熔化(实质是溶于自身的结晶水中),同时吸收热量;在晚上又可缓慢凝固而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
|
|
Na2S2O3·5H2O |
CaCl2·6H2O |
Na2SO4·10H2O |
Na2HPO4·12H2O |
|
熔点(℃) |
40.50 |
29.92 |
32.38 |
35.1 |
|
熔化热(kJ/mol) |
49.7 |
37.3 |
77 |
100.1 |
①上述四种水合晶体盐中最适宜用做潜热材料的两种盐是(用化学式表示)
; 。
② 实际应用时最常采用的(由来源和成本考虑)应该是 。
 2Al(OH)3↓+CO32-
2Al(OH)3↓+CO32-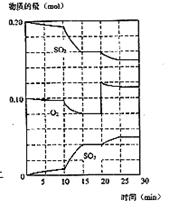 (10分)在一定条件下,二氧化碳和氧气发生如下反应:
(10分)在一定条件下,二氧化碳和氧气发生如下反应: 2SO3(g) ΔH<0
2SO3(g) ΔH<0  Mg+Cl2↑
Mg+Cl2↑