网址:http://m.1010jiajiao.com/timu3_id_263551[举报]
海水中提取镁的工业流程如下图所示:

回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
A.空气 B.氧气 C.水蒸气 D.氢气
⑹镁可用于生产金属钛,主要步骤有:①在高温下,向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体;②在稀有气体(如氩)氛围和加热条件下,用镁与TiCl4反应可得到钛。写出上述两步反应的化学方程式。
反应①:____________________________________________________________;
反应②:____________________________________________________________。
查看习题详情和答案>>
海水中提取镁的工业流程如下图所示: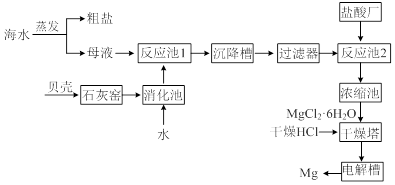
回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
| A.空气 | B.氧气 | C.水蒸气 | D.氢气 |
反应①:____________________________________________________________;
反应②:____________________________________________________________。 查看习题详情和答案>>
海水中提取镁的工业流程如下图所示:
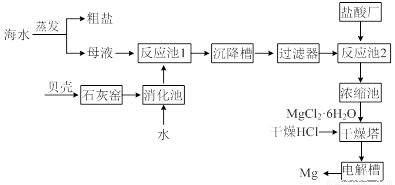
回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
A.空气 B.氧气 C.水蒸气 D.氢气
⑹镁可用于生产金属钛,主要步骤有:①在高温下,向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体;②在稀有气体(如氩)氛围和加热条件下,用镁与TiCl4反应可得到钛。写出上述两步反应的化学方程式。
反应①:____________________________________________________________;
反应②:____________________________________________________________。
查看习题详情和答案>>
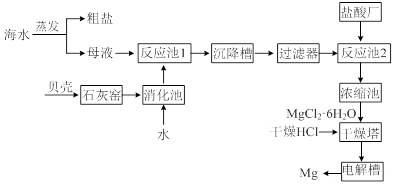
回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
| A.空气 | B.氧气 | C.水蒸气 | D.氢气 |
反应①:____________________________________________________________;
反应②:____________________________________________________________。
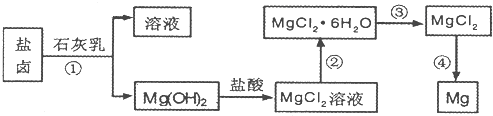
(1)从转化(①得到的Mg( OH)2沉淀中混有少量的Ca( OH)2,除去少量Ca( OH)2的方法是先将沉淀加入到盛有
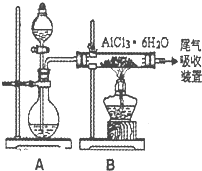
(2)写出转化④中发生反应的化学方程式
(3)已知转化③的反应原理与制取无水AlCl3相同下图是制取无水AlCl3实验装置图.装置A中的两液体分别是浓硫酸和浓盐酸.请回答:
①D为什么不直接加热来制取无水AlCl3,请用化学方程式表示:
②分液漏斗中应盛装的试剂是
③由分液漏斗向烧瓶中加试剂时应注意的事项是