24.(10分)在一个盛有催化剂的容积可变的密闭容器中,保持一定温度和压强,进行以下反应,N2(气)+3H2(气) 2NH3(气),已知加入1mol N2和4molH2时,达到平衡后生成amolNH3,在相同条件下,且保持平衡时各组分的百分含量不变,填写表中空白:
2NH3(气),已知加入1mol N2和4molH2时,达到平衡后生成amolNH3,在相同条件下,且保持平衡时各组分的百分含量不变,填写表中空白:
|
编号 |
起始物质的量(mol) |
平衡时NH3的物质的量(mol) |
||
|
N2 |
H2 |
NH3 |
||
|
已知 |
1 |
4 |
0 |
a |
|
(1) |
1.5 |
6 |
0 |
|
|
(2) |
|
|
1 |
0.5a |
|
(3) |
m |
n(n≥4m) |
|
|
23.(9分)某温度下SO2的转化反应的平衡常数K =532.4
2SO2+O2  2SO3
2SO3
下面三个混合体系中各物质的浓度如下表:
|
体系 |
c(SO2) mol/L |
c(O2) mol/L |
c(SO3) mol/L |
反应方向 |
|
(1) |
0.0600 |
0.400 |
2.000 |
|
|
(2) |
0.0960 |
0.300 |
0.500 |
|
|
(3) |
0.0862 |
0.263 |
1.020 |
|
试判断各体系中反应进行的方向:
体系(1) ;
体系(2) ;
体系(3) 。
22.(10分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。已排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
3.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol/L硫酸 |
均无明显现象(无气泡产生) |
||||
|
3.0mol/L硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式______________________________________________
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是_______________________
________________________________________________________________________________。
(3)同学们在探究0.01mol/L KMnO4溶液与0.2mol/L H2C2O4溶液发生反应2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O时发现,反应前阶段KMnO4溶液褪色速率非常缓慢,但后阶段的褪色速率却非常快,同学们分析后阶段褪色速率却非常快是因为某物质对上述反应起了______作用,该物质可能是_________。
(4)受上述探究实验的启发,同学们顺利提出了“铝与稀盐酸和稀硫酸反应差异的原因”。你能对该问题原因做出某些假设或猜想吗?(列出两种即可,Al3+的影响已经排除)
假设一:________________________________________________________________________;
假设二:________________________________________________________________________;
如何设计实验验证你的假设,请简述你设计的实验的要点:
_______________________________________________________________________________。
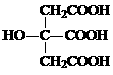
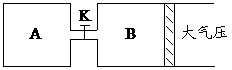 (1)B中X 的转化率α(X)B为__________。
(1)B中X 的转化率α(X)B为__________。