24、(11)如图某化学实验小组从商店买回的浓硫酸试剂标签的部分内容,该小组在课外资料中获得以下信息:浓硫酸腐蚀性很强,溶于水时释放大量的热,浓硫酸的硫酸分步电离。
|
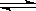 HSO4- + H+
HSO4- + H+
向HSO4- 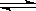 SO42- +
H+
SO42- +
H+
由于试剂瓶口密封签已破损,他们怀疑该硫酸质量分数与标签不符,确定开展研究.
甲认为可以用一种精密仪器测量该溶液的C(H+),若C(H+) =36.8 mol•L-1,该溶液的质量分数为0.98;
乙认为,即使有精密的仪器,甲方案也不行,建议用重量分析法来测。具体设想:取一定体积该硫酸和足量BaCl2反应,过滤、洗涤、干燥沉淀,称量沉淀的质量
丙则建议用“中和滴定”进行测量,设想如下:A、准确量取一定体积的硫酸,并用适量的水稀释;B、往稀释后溶液中滴入2-3滴酚酞;C、用一定浓度的NaOH溶液滴定,直到出现滴定终点为止;D、记录消耗的NaOH溶液的体积。
回答下列问题:。
(1)乙推断“甲同学方案不可行”的理由是: 。
(2)乙方案的关键操作有两点:①确保SO42-完全反应,②洗涤沉淀,确保沉淀不夹杂质。在实验中如何认定SO42-完全反应?
。
(3)如何稀释浓硫酸溶液?
。
(4)丙方案下列操作会使测定结果偏大 。
①在滴定前未用NaOH标准溶液润洗滴定管
②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分气泡消失
③锥形瓶用水洗干净后,未用待测液润洗
④开始时平视读数,滴定完成时俯视读数
(5)丙在实验中,分别取硫酸5.00mL,用5.00mol/L NaOH滴定三次,终点时,得到的NaOH的体积依次为35.65mL、40.62mL、35.55mL,试通过计算该硫酸是否合格.(要计算过程)
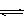 (9分)把一小块试纸放在表面皿(玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的PH。(2分)CO32-
+H2O H CO3-
+ OH- ,(2分) 7-13 。(2分),
(9分)把一小块试纸放在表面皿(玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的PH。(2分)CO32-
+H2O H CO3-
+ OH- ,(2分) 7-13 。(2分), xC(g)
xC(g) , H2(g) + 1/2O2(g) == H2O(l)的△H=–285.8 kJ·
, H2(g) + 1/2O2(g) == H2O(l)的△H=–285.8 kJ·