23.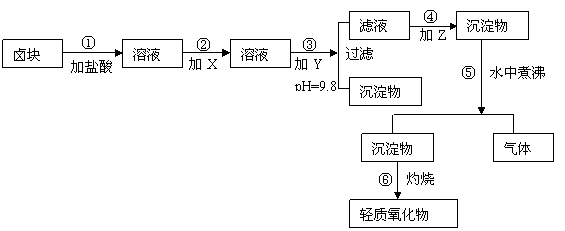 (6分)“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。
(6分)“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。
轻质氧化镁工艺流程图
表1 化学试剂价格表 表2 生成氢氧化物沉淀的值
|
试剂 |
价格(元/ t ) |
|
漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) |
450 2400 2100 600 310 |
|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 |
2.7 7.6 8.3 9.6 |
3.7 9.6Ω 9.8 11.1 |
Ω注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化成为Fe3+,生成Fe(OH)3沉淀而去除之。请填写以下空白:
⑴、在步骤②加入试剂X,最佳选择应是 ,其作用是 。
⑵、在步骤③加入的试剂Y应是 ,之所以要控制pH=9.8,其目的是 。
⑶、在步骤⑤时发生的化学反应方程式是: 。
21.(12分)某课外活动小组设计如下图所示装置,进行氯气的制备及有关性质实验。
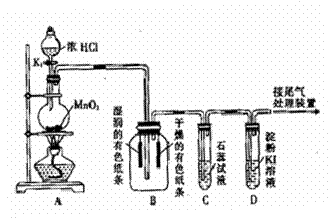 (1)装置A中发生反应的离子方程式
(1)装置A中发生反应的离子方程式
为 。
(2)上述装置中明显存在不足之处,
为保证装置B中实验成功,应在装置
A、B之间添加一个装置,该装置
是 (填“I”、“Ⅱ”或“Ⅲ”)

(3)装置C中溶液发生的颜色变化为
请在方框内填写出颜色变化及导致该阶段颜色变化的粒子符号。
|
阶段 |
1 |
2 |
3 |
|
颜色变化 |
|
|
|
|
粒子符号 |
|
|
|
(4)装置D中起始的实验现象是 。
(5)实验结束后,对装置A的烧瓶中残存的气体的处理方法是 。
20. (6分)A、B、C 三个烧杯中分别盛有相同物质的量浓度的稀硫酸。网
(6分)A、B、C 三个烧杯中分别盛有相同物质的量浓度的稀硫酸。网
|
|
|
(1)A中反应的离子方程式为 ,
B中Cu极电极反应式为 。
(2)C中被腐蚀的金属是 ,总反应方程式为 ,
A.B、C中铁被腐蚀的速率,由大到小的顺序是 。
19.(10分)Ⅰ下表为元素周期表前三周期的一部分。
|
|
|
||
|
X |
|
Z |
|
|
W |
Y |
|
R |
(1)X的氢化物的沸点与W的氢化物的沸点比较: > ___ (填化学式),原因是 。
(2)从下列选项中选出X的基态原子的最外层原子轨道表示式 _ ,另一原子轨道表示式不能作为基态原子的轨道表示式是因为它不符合 。(填序号)。
|
|
C.泡利不相容原理 D.洪特规则
(3)以上五种元素中, 元素原子失去核外第一个电子需要的能量最多(填元素符号)。
II.(1).一元素原子的N层上只有1个电子,该元素原子各内层均已充满,写出该原子电子排布式: ,
(2).乙烯分子中有 个σ键, π键,以 杂化。

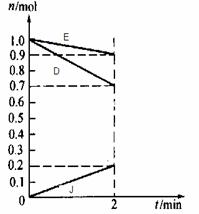 (3)某温度时,在2L容器中,D、E、J三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:该反应的化学方程式为_________________。反应开始至2min,用J表示的平均反应速率为____________。
(3)某温度时,在2L容器中,D、E、J三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:该反应的化学方程式为_________________。反应开始至2min,用J表示的平均反应速率为____________。