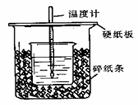
28.(14分)某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下:镁条、铝条、铝粉、钠、新制的Na2S溶液,新制的氯水,0.5mol/L的盐酸,3mol/L的盐酸,酚酞试液。其设计的实验方案及部分实验现象如下表:
|
实验步骤 |
实验现象 |
|
①将一小块金属钠放入滴有酚酞试液的冷水中 |
钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
|
②将表面积大致相同的镁条和铝条(均已用砂纸打磨过),分别投入足量的相同体积的0.5mol/L的盐酸中 |
镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
|
③将新制的氯水滴加到新制的Na2S溶液中 |
|
|
④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 |
均剧烈反应产生气体,但铝粉消失比镁条快 |
请回答下列问题:
(1)实验③的现象是 ,该反应的离子方程式为 。
(2)由实验③得出的实验结论是 。
(3) 由实验②可得出决定化学反应快慢的主要因素是 。
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确? (填“是”或“否”)。
(5)通过实验④说明要加快化学反应速率可 或 。
22.下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述
正确的是
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.134 |
0.089 |
0.102 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.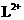 与
与 的核外电子数相等 B.L与T形成的化合物具有两性
的核外电子数相等 B.L与T形成的化合物具有两性
C.氢化物的稳定性为 D.单质与浓度相等的稀盐酸反应的速率为Q<L
D.单质与浓度相等的稀盐酸反应的速率为Q<L