19.(8分)A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;7.8gB的氢氧化物恰好能与100mL3mol/L盐酸完全反应;B原子核中质子数比中子数少1。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素A位于 (填周期和族),它的最高价氧化物对应的水化物的电子式为__ ,其中含有的化学键有______________。
(2)D的氢化物属于 分子(填极性、非极性)。
(3)B与D形成的化合物与A的最高价氧化物对应的水化物反应的离子方程式:_______ 。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为___________ 。
20(6分)某课外兴趣小组对H2O2的分解速率做了如下实验探究。
⑴下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
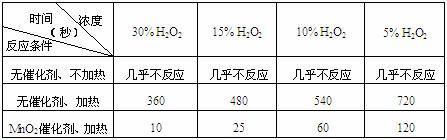
①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解
速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
。
⑵将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木
条测试。测定结果如下:
|
催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
|
粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
|
块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2发生的化学反应方程式_______________ _________。
②实验结果说明催化剂作用的大小与________ ________________有关。
答案:(7分)⑴① 温度 、 催化剂
② 升高温度化学反应速率增大或加催化剂化学反应速率增大
⑵①______2H2O2 = 2H2O+O2↑______。
②_______催化剂的聚集状态或表面积______。
18、(7分)A、B、C、D四种元素在周期表中分别处于元素X的四周,已知X元素最高价氧化物的化学式为XO3,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。试确定:
|
E |
B |
|
|
…A |
X |
C… |
|
|
D |
|
(1)排列C、D、X最高价氧化物对应水化物的酸性由强到弱的顺序 ,排列A、B、X气态氢化物的稳定性由强到弱的顺序 (用化学式表示)。
(2)E的氢化物是由 (填“极性”“非极性”)键形成的,且能与E的最高价氧化物对水化物发生反应生成一种盐,写出该反应的离子方程式 .
(3)用电子式表示C和11号元素形成化合物过程: ,
 答案:(1)小于(2)286
(3)小于(4)产物无污染(其它合理均可得分)
答案:(1)小于(2)286
(3)小于(4)产物无污染(其它合理均可得分)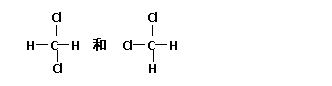 (4分)将下列物质进行分类:①
(4分)将下列物质进行分类:①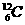 与
与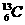 、②O2与O3、③正丁烷和异丁烷、④金刚石和
、②O2与O3、③正丁烷和异丁烷、④金刚石和
 2SO3,若反应物浓度由 0.1 mol·L-1降到
2SO3,若反应物浓度由 0.1 mol·L-1降到