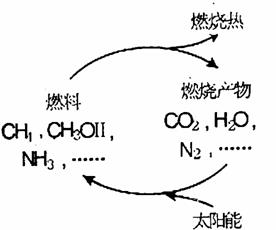
22.(12分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
|
时间/min |
1 |
2 |
3 |
4 |
5 |
|
氢气体积/mL |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0-1、1-2、2-3、3-4、4-5 min)反应速率最大________,原因是________________________________________。
(2)哪一段时段的反应速率最小________,原因是________________________________。
(3)求2-3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)________________________________________。
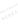 (4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)________。
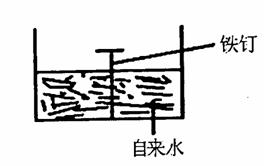
18.(12分)元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。
|
A |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
D |
|
F |
|
|
|||||||
|
G |
|
Q |
|
|
M |
R |
|
||||||||||
|
N |
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
(1)表中T的元素符号为________,金属性最强的元素是________(填元素符号)。
(2)元素的非金属性:M________R(填“>”或“<”)。
(3)R的最高价氧化物对应水化物的化学式是________。
(4)F、G两元素形成的淡黄色固体物质的电子式为________________,该物质含有的化学键的类型是________________。
(5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径电大到小的顺序是________________________(填离子符号)。
(6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为________________________________。
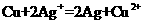 ”设计一个原电池(正极
”设计一个原电池(正极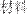 用碳棒)。
用碳棒)。 是________,发生________反应(填“氧化”或“还原”),电极反应为:______________________________电解质溶液是________;
是________,发生________反应(填“氧化”或“还原”),电极反应为:______________________________电解质溶液是________;