3.如果忽略电子的质量,质子、中子的相对质量分别取其近似整数值,那么,原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
思考:金属均由原子构成,而原子中又含有带电粒子,那它为什么不显电性呢?由此可得什么结论?
总结:核电荷数____核内质子数_____核外电子数.
讨论:原子核与原子的关系是怎样呢?
能形象地比喻一下原子核和原子的体积的相对大小吗?
结论:
从表中所示电子、质子、中子的相对质量也可得出原子的质量主要集中在_________上的结论.从表中可看出,质子和中子的相对质量均近似等于1,而电子的质量只有质子质量的1/1836,如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似值加起来,所得数值便近似等于该原子的相对原子质量,我们把其称为质量数,用符号A表示.中子数规定用符号N表示.则得出以下关系:
结论:质量数(A)_____质子数(Z)_____中子数(N)
这样,只要知道上述三个数值中的任意两个,就可推算出另一个数值来.
在化学上,我们用符号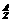 X来表示一个质量数为A、质子数为Z的具体的X原子.比如
X来表示一个质量数为A、质子数为Z的具体的X原子.比如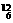 C表示质量数为12,原子核内有6个质子和6个中子的碳原子.
C表示质量数为12,原子核内有6个质子和6个中子的碳原子.
分析:“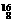 O”与“O”所表示的意义是否相同?
O”与“O”所表示的意义是否相同?
结论:为了熟记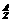 X所表示意义及A、Z、N之间的关系,请同学填写下表:
X所表示意义及A、Z、N之间的关系,请同学填写下表:
|
粒子符号 |
质子数(Z) |
中子数(N) |
质量数(A) |
用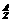 X表示为 X表示为 |
|
①O |
8 |
|
18 |
|
|
②Al |
|
14 |
27 |
|
|
③Ar |
18 |
22 |
|
|
|
④Cl |
|
|
|
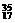 Cl Cl |
|
⑤H |
|
|
|
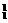 H H |
结论:由以上计算我们可得出,组成原子的各粒子之间的关系可以表示如下:
原子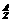 X
X
思考:是不是任何原子核都是由质子和中子构成的?
结论:
思考:假如原子在化学反应中得到或失去电子,它还会显电中性吗?
结论:
思考:离子所带电荷数与原子在化学反应中失去或得到的电子数之间有什么联系?
结论:阳离子所带电荷数_____质子数_____核外电子数
阴离子所带电荷数_____质子数_____核外电子数
总结:这样,我们就可根据粒子的核内质子数与核外电子数的关系,来判断出一些粒子是阳离子还是阴离子.
口答:下列问题:
2.通过人类探索原子结构的历史的介绍,了解假说、模型等科学研究方法和科学研究的历程,培养科学态度和科学精神,体验科学研究的艰辛与喜悦。
学习过程
第一课时
复习:构成原子的粒子有哪些?它们怎样构成原子的?
根据卢瑟福的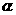 粒子散射实验回答:
粒子散射实验回答:
(1)绝大多数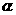 粒子穿过金箔后仍沿原来的方向前进,原因是什么?
粒子穿过金箔后仍沿原来的方向前进,原因是什么?
(2)为什么有少数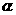 粒子却发生了较大的偏转?
粒子却发生了较大的偏转?
(3)极少数的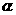 粒子几乎象是被金箔弹了回来,原因是什么?
粒子几乎象是被金箔弹了回来,原因是什么?
讨论:根据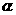 粒子散射的实验现象,提出自己的原子结构模型。
粒子散射的实验现象,提出自己的原子结构模型。
结论:
通过下表来认识一下构成原子的粒子及其性质.
|
构成原子的粒子 |
电子 |
质子 |
中子 |
|
电性和电量 |
1个电子带1个单位负电荷 |
1个质子带1个单位正电荷 |
不显电性 |
|
质量/kg |
9.109×10-31 |
1.673×10-27 |
1.675×10-27 |
|
相对质量① |
1/1836(电子与质子质量之比) |
1.007 |
1.008 |
注①是指对12C原子质量的1/12(1.661×10-27 kg)相比较所得的数值.
讨论:请根据表中所列数据讨论:
11.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为 。
|
|
温度/ ℃ |
催化剂 |
SO2/ mol |
O2/ mol |
|
甲 |
500 |
|
10 |
10 |
|
乙 |
500 |
V2O5 |
10 |
5 |
|
丙 |
450 |
|
8 |
5 |
|
丁 |
500 |
|
8 |
5 |
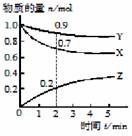 某温度时,在2 L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
某温度时,在2 L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。