摘要:通过构成物质的基本微粒的质量.电性的认识,了解微观世界的物质性,从而进一步认识物质世界的微观本质,通过原子中存在电性不同的两种微粒的关系.认识原子是矛盾的对立统一体.
网址:http://m.1010jiajiao.com/timu3_id_193376[举报]
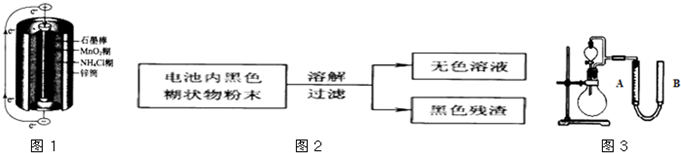
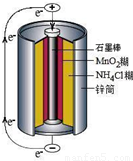
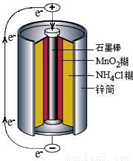
锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
(1)锌锰干电池的负极电极反应式是______,电路中每通过0.4mole-,负极质量减少______g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
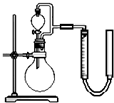
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定).
①实验一、二中参加反应的H2O2的物质的量之比为______;
②实验二中反应的离子方程式为______;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意______.
查看习题详情和答案>>
(1)锌锰干电池的负极电极反应式是______,电路中每通过0.4mole-,负极质量减少______g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验

已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量. | 生成白色沉淀,______ | 无色溶液中 存在Zn2+离子 |
| ②______ | ______ | 无色溶液中 存在NH4+离子 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
②实验二中反应的离子方程式为______;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意______.
锌锰干电池是最早使用的化学电池,其基本构造如图所示.
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如右图所示.将等物质的量浓度、等体积H2O2溶液加入烧瓶中,分别进行2个实验(气体的体积在相同条件下测定).
实验一、二中参加反应的H2O2的物质的量之比为______,实验二中反应的离子方程式为______.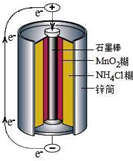
查看习题详情和答案>>
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ |
无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |

| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 |
MnO2做氧化剂,生成Mn2+离子 |

锌锰干电池是最早使用的化学电池,其基本构造如图所示.
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
NH3↑+H2O
 查看习题详情和答案>>
查看习题详情和答案>>
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |
 查看习题详情和答案>>
查看习题详情和答案>>
锌锰干电池是最早使用的化学电池,其基本构造如图所示.
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
NH3↑+H2O
 查看习题详情和答案>>
查看习题详情和答案>>
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |
 查看习题详情和答案>>
查看习题详情和答案>>
(16分)等电子原理的基本观点是:原子数相同且价电子总数相等的分子或离子具有相同的化学键类型和空间构型,互称为等电子体。等电子体的结构相似,物理性质相近。如:N2、CO与C22-、CN-为等电子体。
(1)已知CaC2为离子化合物,则CaC2的电子式为 。
(2)聚丙烯腈俗称人造羊毛,由丙烯腈分子CH2=CH—CN经聚合反应生成;则CH2=CH—CN中C原子的杂化方式为 ;分子中σ键和π键数之比为 。
(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,则n= 。
(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O ;下表是两者的键能数据(单位:kJ·mol-1)
| | C-O | C=O | C≡O |
| CO | 357.7 | 798.9 | 1071.9 |
| | N-N | N=N | N≡N |
| N2 | 154.8 | 418.4 | 941.7 |
(5)Fe3+,Fe2+,Co3+,Co2+都能与CN-形成配合物。硫酸亚铁溶液中加入过量KCN溶液,可析出黄色晶体K4[Fe(CN)6];若在上述溶液中再通入氯气后,可析出深红色晶体K3[Fe(CN)6];在K4[Fe(CN)6]和K3[Fe(CN)6]晶体中都不存在的微粒间作用力是 。(填标号)
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
(6)写出与NO3-互为等电子体的分子 (写出一种)。 查看习题详情和答案>>