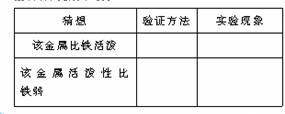
11.下表是某种常见金属的部分性质:

将该金属投入冷水中无变化,投入稀盐酸中,可产生大量的无色气体。根据上述信息回答:
(1)试推断该金属可能的一种用途 ,该金属的活动性比铜 (填“强”或“弱”)
(2)请自选试剂,设计实验探究该金属与铁的活动性强弱,并完成下表:
认识,已有几百年的历史,经历了一个由浅入深的认识过程。
(1)1905年深入研究了水和液氨的相似性,把阿伦尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论。该理论认为:凡是能离解而产生溶剂正离子的物质为酸,凡是能离解而产生溶剂负离子的物质为碱。试写出液氨弱电离的方程式(生成的2种粒子电子数相等): ;
(2)1923年化学家提出了酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照质子理论,下列微粒在水溶液中既可看作酸又可看作碱的是 ;
A.H2O B.NH+4 C.OH- D.HCO-3
E.CH3COO- F.Cl-
(3)1923年G.N.Lewis提出酸碱电子理论,他对酸碱的定义为:酸是在反应过程中能够接受电子对的物质,称为电子对接受体;碱是在反应过程中能够给出电子对的物质,称为电子对给予体。如H+(电子对接受体)+[∶OH]-(电子对给予体)→H∶OH
试指出下列两个反应中的酸或碱
①H3BO3+H2O H++B(OH)-4该反应中的碱是
H++B(OH)-4该反应中的碱是
(填H3BO3或H2O)②NaH+H2O==NaOH+H2↑ 该反应中的酸是 (填NaH或H2O)
资料卡片
金属冶炼的方法
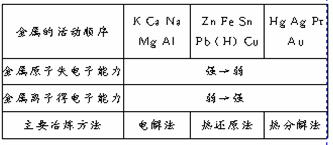
轻松一题: 下列说法不正确的是( AC )
A.有些活泼金属如铝可用作热还原剂来冶炼金属
B.用电解熔融NaCl的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收旧金属可以重新制成金属或它们的化合物
|
自我反馈 导学园地 [1]组成 [2]结构 [3]变化 [4]合成 [5]创造 [6]原子 [7]分子 [8]预测化学反应 [9]判断化学反应的方向 [10]合成化学的发展 [11]功能材料的设计 |
第二课时 化学是人类创造新物质的工具
导学园地
1?随着现代[1] 、[2] 和[3] 技术的发展,人们已经能够[4] 并[5] 出符合某种需要、具有特定性质的新物质。
2?化学[6] 所取得的巨大成就,帮助化学家[7] 或从自然界[8] 出更多的物质,以满足人类的需要。
3?计算机技术的发展,使化学研究进入了[9] 水平,[10] 的思想为合成人类需要的新物质开辟了更广阔的道路。
巩固练习
