2、离子半径大小的比较
(1)具有相同电子层结构的离子半径大小的比较
电子层数相同,随着核电荷数的增加,原子核对核外电子的吸引能力 ,半径 。
(2)同主族离子半径大小的比较
元素周期表中从上到下,电子层数逐渐 ,离子半径逐渐 。
(3)同一元素的不同离子的半径大小比较
同种元素的各种微粒,核外电子数越多,半径 ,高价阳离子半径 低价离子半径。
方法引导:在教材p11页画出以原子序数为横坐标、元素的主要化合价为纵坐标的折线图。对于元素主要化合价的变化,你的结论是什么?
交流研讨:展示其折线图,交流观点。
总结:随着原子序数的递增,元素的化合价呈现周期性变化。
且有以下量的关系:
│最高正价│+│负价│=_______
引导探究:综合以上的事实,各自发表自己的观点。大家可以得出什么结论?
总结:元素周期律:元素的性质随着元素原子序数的递增,而呈现出------ 的变化。

探究:元素的性质是由元素原子的哪一部分决定的?那么元素性质随原子序数的递增呈现出周期性变化的根本原因是什么?
总结:元素性质的周期性变化是--------------------------呈现周期性变化的必然结果
|
|
|

小结:

 以1-18号元素核外 分析归纳
最外层电子数随原子序数
以1-18号元素核外 分析归纳
最外层电子数随原子序数
 电子排布为例
递增呈周期性变化
电子排布为例
递增呈周期性变化

 决定
①元素原子半径的周期性变化 总结归纳
元素周期律
决定
①元素原子半径的周期性变化 总结归纳
元素周期律

 ②元素主要化合价的周期性变化
元素周期律实质
②元素主要化合价的周期性变化
元素周期律实质
达标检测:
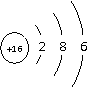

 根据下列原子结构示意图回答(用编号回答):
根据下列原子结构示意图回答(用编号回答): ①
②
③
④
①
②
③
④
