19.(原创)(10分)几种短周期元素的原子半径及其某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
化合价 |
-1 |
-2 |
+4、-4 |
+6、-2 |
+5、-3 |
+3 |
+2 |
+1 |
|
原子半径/nm |
0.071 |
0.074 |
0.077 |
0.102 |
0.110 |
0.143 |
0.160 |
0.186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题。涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期, 族;
(2)A、H、J对应离子的半径由大到小的顺序是(填离子符号) 。
(3)B的一价阴离子团与J的+1阳离子能形成化合物,用电子式表示该化合物的形成过程 。
(4)H的氧化物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为 ,比较H, I ,J三种元素的最高价氧化物对应水化物的碱性强弱(用化学式表示), > >
20(12分) 我国实现了“神舟”系列载人飞船的成功发射,标志着“炎黄子孙千年飞天梦想实现了”
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料最可能具有的性质是
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料在任何条件下不可能发生分解
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是: N2O4 + N2H4 → N2 + H2O 。请配平该反应方程式:
----N2O4 + ----N2H4 -- ----N2 + ----H2O
该反应中被氧化的原子与被还原的原子物质的量之比是 。
这个反应应用于火箭推进器,除释放大量的热量和快速产生大量气体外,还有一个很大的优点是 。
(3)为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。
①写出KO2与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似):
____________________________;
②你选择的供氧剂是: 。
21(14分).甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、丙两元素同主族,其余均为常见化合物,他们在一定条件下有如下转化关系:(反应中生成的水已略去)
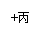
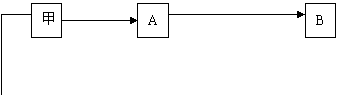


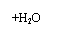




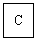
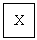


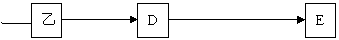
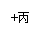


(1)丙的名称是__________;C的化学式是__________;
(2)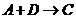 的反应属于下列何种反应类型(填序号)________
的反应属于下列何种反应类型(填序号)________
A.化合反应 B.氧化还原反应
C.非氧化还原反应 D.离子反应
(3)将D转化为E的化学方程式:__________________________
(4)写出A与H2O反应的离子方程式:
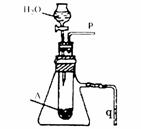 (5)若用如右图所示装置来证明A和H2O的反应:
(5)若用如右图所示装置来证明A和H2O的反应:
①是放热反应,②生成了丙。
简单合理的实验操作是;
①
②
22(14分).根据下图回答问题:
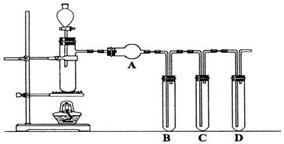
(1)装置气密性的检验须在盛放药品前进行。在上述装置中,往试管B、C、D中各加入5mL蒸馏水封住导管口,各连接处都紧密而不漏气的情况下,点燃酒精灯,微热带支管的试管一会儿,试管B、C、D中未出现气泡;熄灭酒精灯后,试管B、C、D中导管内水面也未上升,其原因是:__________________。
(2)一般来说,硫酸的质量分数大于60%,才具有较强氧化性,且越浓氧化性越强。
甲同学利用上述装置,验证上述结论(已知98%的浓硫酸的密度为1.84g·cm-3)。他先向试管B中加入5mL品红试液,向试管C中加入5mLNaOH溶液;向带支管的试管中放入铜粉和3mL水,然后从分液漏斗向带支管试管中滴加98%的浓硫酸10滴(约0.5mL),加热至沸腾,这时带支管试管中溶液颜色是否有明显变化_____(填“无”或“有”),试用数据解释其原因_____________;该同学用分液漏斗再向带支管试管中加98%的浓硫酸20mL,并加热至沸腾,试管B中实验现象是 ,写出带支管的试管中的化学方程式 。
(3)乙同学利用上述装置来检验浓硫酸和木炭粉在加热条件下发生反应的全部产物。
可供选用的试剂有:a澄清石灰水 b足量酸性KMnO4溶液 c品红溶液
d无水CuSO4固体,将试剂编号填入空格中
A中加入试剂是__________, B中加入试剂是 ,
C中加入试剂是___________,D中加入试剂是 。
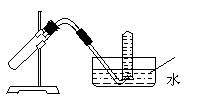 8.右图装置可用于( )
8.右图装置可用于( )
 (2)
,
(2)
,