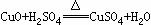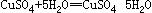36.(10分)在盛有NaI、AgNO3、CaCl2、K2CO3、HBr的已失去标签的五种无色溶液的试剂瓶上,分别贴上①②③④⑤的编号,使它们两两反应,产生的现象在下表中列出。请在表中的结论格内,填写这些编号所代表的物质的名称。
|
|
① |
② |
③ |
④ |
⑤ |
|
① |
-- |
无色↑ |
白色↓ |
白色↓ |
无 |
|
② |
无色↑ |
-- |
无 |
浅黄↓ |
无 |
|
③ |
白色↓ |
无 |
-- |
白色↓ |
无 |
|
④ |
白色↓ |
浅黄↓ |
白色↓ |
-- |
黄色↓ |
|
⑤ |
无 |
无 |
无 |
黄色↓ |
-- |
|
结论 |
|
|
|
|
|
答案:①-⑤分别为K2CO3、HBr、CaCl2、AgNO3、NaI。
33.请你按要求填写下表,以除去下列物质中所混有的少量杂质。
|
混 合 物 |
实验方案 |
反应化学方程式 |
|
(1)铁粉中混有少量铝粉 |
|
|
|
(2)Na2CO3固体中混有少量NaHCO3 |
|
|
|
(3)FeCl3溶液中混有少量FeCl2 |
|
|
答案:
|
混合物 |
实验方案 |
反应化学方程式 |
|
(1) |
将混合物置于烧杯中,加入足量的NaOH溶液,反应后,过滤。 |
2Al +2NaOH +2H2O
==2NaAlO2 +3H2↑ |
|
(2) |
将混合物置于适当的容器中(如:试管、蒸发皿等),加热。 |
2NaHCO3 Na2CO3
+H2O +CO2↑ Na2CO3
+H2O +CO2↑ |
|
(3) |
向该FeCl3溶液中通入适量的Cl2 |
2FeCl2+Cl2
=2FeCl3 |
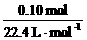 =0.002 mol,故已反应的CaCO3为0.002
mol。样品中生石灰的质量为:5.92 g-0.12 g-0.002 mol×100 g·mol-1=5.60
g,n(CaO)=0.10 mol
=0.002 mol,故已反应的CaCO3为0.002
mol。样品中生石灰的质量为:5.92 g-0.12 g-0.002 mol×100 g·mol-1=5.60
g,n(CaO)=0.10 mol 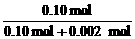 ×100%=98%
×100%=98% 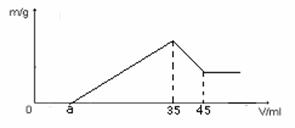 准确称量6g铝士矿样品(含Al2O3 、Fe2O3 、SiO2 )放入盛100 mL某浓度的硫酸溶液烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1NaOH
溶液,产生的沉淀的质量m 与加入NaOH 溶液的体积V关系如下图:
准确称量6g铝士矿样品(含Al2O3 、Fe2O3 、SiO2 )放入盛100 mL某浓度的硫酸溶液烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1NaOH
溶液,产生的沉淀的质量m 与加入NaOH 溶液的体积V关系如下图: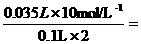 1.75 mol·L-1
1.75 mol·L-1
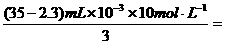 0.109mol
0.109mol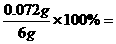 12%
12%
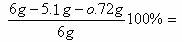

 工业生产的纯碱中常含有少量的NaCl等杂质。下图是测定产品中碳酸钠质量分数的实验装置。实验步骤有:
工业生产的纯碱中常含有少量的NaCl等杂质。下图是测定产品中碳酸钠质量分数的实验装置。实验步骤有: ⑴正确操作顺序是(填写符号)
⑴正确操作顺序是(填写符号) ⑵操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是
;装置甲的作用是
;
⑵操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是
;装置甲的作用是
;
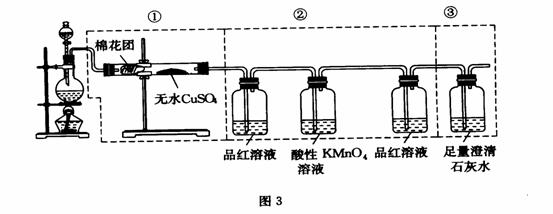
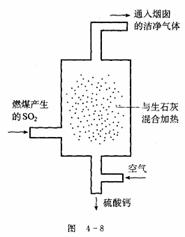 (2) 现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO4•5H2O)的合理方案,用简要的文字和化学方程式说明。
(2) 现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO4•5H2O)的合理方案,用简要的文字和化学方程式说明。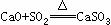
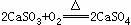
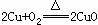 第二步
第二步