网址:http://m.1010jiajiao.com/timu3_id_174349[举报]
(1)写出并配平该氧化还原反应的离子方程式:
(2)向(1)中反应后的溶液里加入酸性高锰酸钾溶液,得还原产物Mn2+(无色),反应的离子方程式为
(3)某同学用上述原理测定一种含Cu2O的矿石中Cu2O的质量分数:称量5.0g矿石溶于足量的硫酸铁和硫酸的混合溶液中,充分反应后,用酸性高锰酸钾溶液滴定,消耗0.100 0mol?L-1的高锰酸钾溶液的体积为100.00mL.
①滴定时,滴定终点的颜色为
②该同学测得矿石样品中Cu2O的质量分数为
③下列情况使测定结果一定偏高的是
A.开始和终点都是仰视读数
B.没有用待装液润洗滴定管
C.称量时,砝码与样品放反了
D.样品中含有较强还原性杂质
E.高锰酸钾溶液中含有N
| O | - 3 |
F.用酸性高锰酸钾溶液润洗锥形瓶.
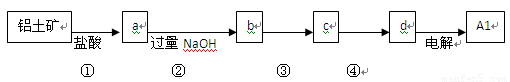
铝士矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法不正确的是
A.①、②中除加试剂外。还需要进行过滤操作
B.a 、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d 一定是氧化铝
查看习题详情和答案>>
铝士矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法不正确的是
A.①、② 中除加试剂外。还需要进行过滤操作
B.a 、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d 一定是氧化铝
查看习题详情和答案>>
(10分)已知高锰酸钾、二氧化锰在酸性条件下能将草酸钠(Na2C2O4)氧化:
MnO4—+C2O42—+H+―→Mn2++CO2↑+H2O(未配平);
MnO2+C2O42—+H+―→Mn2++CO2↑+H2O(未配平)。
为测定某软锰矿中二氧化锰的质量分数,准确称量1.20 g软锰矿样 品,加入2.68 g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到容量瓶中用蒸馏水稀释至刻度,从中取出25.0 mL,用0.0200 mol·L-1高锰酸钾溶液进行滴定。当加入20.0 mL溶液时恰好完全反应,试根据以上信息完成下列各题:
品,加入2.68 g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到容量瓶中用蒸馏水稀释至刻度,从中取出25.0 mL,用0.0200 mol·L-1高锰酸钾溶液进行滴定。当加入20.0 mL溶液时恰好完全反应,试根据以上信息完成下列各题:
(1)配平上述两个离子方程式:
___MnO+___C2O+___H+===___Mn2++___CO2↑+___H2O;
___MnO2+__C2O+___H+===___Mn 2++___CO2↑+__H2O。
2++___CO2↑+__H2O。
(2)欲求得软锰矿中二氧化锰的质量分数,还缺一个数据,这个数据是__________(填数据所代表的意义)。
(3)若该数据的数值为250,求该软锰矿中二氧化锰的质量分数(写出计算过程)。(4分)
铝士矿(主要成分为![]() 、
、![]() 、
、![]() )是提取氧化铝的原料.提取氧化铝的
)是提取氧化铝的原料.提取氧化铝的
工艺流程如下:
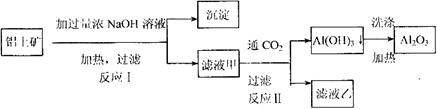
(1)写出反应Ⅱ的离子方程式_________________________________________________
(2)已知滤液乙的成分除![]() 外还含有
外还含有![]() 、
、![]() 中的一种或两种,所含物质的质量分数都在5%以上。请设计合理实验探究该滤液乙中
中的一种或两种,所含物质的质量分数都在5%以上。请设计合理实验探究该滤液乙中![]() 、
、![]() 的存在。仅限选择的仪器和试剂:烧杯、试管、带导管的橡皮塞、玻璃棒、蒸发皿、泥三角、三脚架、铁架台、酒精灯、过滤器、洗气瓶、滴管、药匙;lmol?L
的存在。仅限选择的仪器和试剂:烧杯、试管、带导管的橡皮塞、玻璃棒、蒸发皿、泥三角、三脚架、铁架台、酒精灯、过滤器、洗气瓶、滴管、药匙;lmol?L![]() 盐酸、2mol?L
盐酸、2mol?L![]() MgCl2溶液、澄清饱和石灰水。
MgCl2溶液、澄清饱和石灰水。
完成以下实验探究过程:
①提出假设:
假设1:滤液乙中除![]() 外还含有__________________;
外还含有__________________;
假设2:滤液乙中除![]() 外还含有_________________;
外还含有_________________;
假设3:滤液乙中除![]() 外还含有
外还含有![]() 、
、![]() ;
;
②设计实验方案:基于假设3,设计出实验方案(筒述实验操作、预期现象和结论)。
___________________________________________________________________________
__________________________________________________________________________。
(3)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为_____________________________________________________________
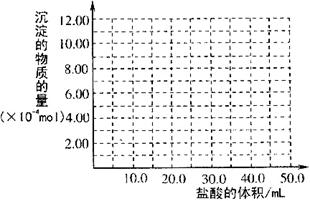 (4)取(3)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol?L
(4)取(3)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol?L![]() 盐酸溶液,当加入50.0mL盐酸溶液时,生成的沉淀恰好溶解。
盐酸溶液,当加入50.0mL盐酸溶液时,生成的沉淀恰好溶解。
①加入50.0mL盐酸溶液发生
的离子反应按先后顺序依次为
__________________________
__________________________。
②请画出生成沉淀的物质的量
与加入盐酸体积的关系图。
查看习题详情和答案>>