20、Ⅰ下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。(12分)(1)请在上表中用实线补全元素周期表边界。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
|
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2)元素②与⑤形成的化合物的电子式为 。元素③氢化物的结构式为 。
元素①的单质、元素②的单质都和水反应,现象更为剧烈的是 。
元素④一般在化合物中显 价,但若能与 形成化合物,所显示的价态则恰好相反。(此题涉及到①②③④⑤时用对应的元素符号表示)
(3)元素A、B都是短周期元素,元素A与④同主族,元素A与B同周期,而且B的最外层电子数与电子层数相同,请在上方元素周期表中标明元素A、B的位置(用对应的元素符号表示)。
比较B原子半径与A原子半径: > (用对应的元素符号表示)。
比较A、B的最高价氧化物水化物的酸性强弱为: > (用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的 ,请写出元素在元素周期表中的位置与元素原子结构的关系: 。
*Ⅱ. (7分) 根据下图的实验现象,推断A、B、E、F、H各是什么物质。(填化学式)
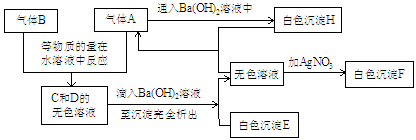
(1)A是________,B是________,E是________,F是________,H是________。
(2)A、B以等物质的量在水溶液中反应的离子方程式是:_____________________。
18、 (4分) 归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质/元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
– 218.4 |
113 |
|
452 |
|
单质沸点(℃) |
– 183 |
444.6 |
685 |
1390 |
|
主要化合价 |
– 2 |
– 2、+ 4、+ 6 |
– 2、+ 4、+ 6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是______________________;(2)碲的化合价可能有__________________;
(3)硫、硒、碲的氢化物的稳定性由强至弱的顺序是__________________(填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质。
*19、 (5分)一种无色溶液具有以下性质:(1)能使石蕊试纸变红;(2)加热时产生无色有刺激性气味气体,蒸干时无残渣;(3)能使溴水褪色;(4)加Ba(OH)2溶液有白色沉淀生成,该沉淀溶于稀盐酸。此无色溶液是_______。写出有关的化学方程式____________________;___________________;______________________________;______________________________。
 第六章 氧族元素 环境保护
第六章 氧族元素 环境保护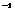 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。填写下列空格:
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。填写下列空格: ②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:_____________________________________
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:_____________________________________