2、根据反应中物质是否得到氧或失去氧,分为氧化反应和还原反应。
⑴氧化反应:物质
氧的反应,比如:C+O2 CO2
CO2
⑵还原反应:物质
氧的反应,比如:CuO+H2 Cu+H2O
Cu+H2O
课堂研究
[讨论1]对于反应Fe2O3+3CO 2Fe+3CO2, 失去氧,发生了 (填“氧化”或“还原”)反应; 得到氧,发生了 (填“氧化”或“还原”)反应。也就是说,氧化反应和还原反应是
(填“先后”或“同时”)发生的。
2Fe+3CO2, 失去氧,发生了 (填“氧化”或“还原”)反应; 得到氧,发生了 (填“氧化”或“还原”)反应。也就是说,氧化反应和还原反应是
(填“先后”或“同时”)发生的。
氧化还原反应的第一层定义:凡是物质有 氧和 氧的反应。
[讨论2]对于反应Fe2O3+3CO 2Fe+3CO2,讨论该氧化还原反应中元素的化合价在反应前后的变化关系:
元素的化合价升高,
元素的化合价降低。
2Fe+3CO2,讨论该氧化还原反应中元素的化合价在反应前后的变化关系:
元素的化合价升高,
元素的化合价降低。
[思考]①是否只有得氧失氧的反应才是氧化还原反应?
②如果一个反应中没有氧的得失,是否一定不是氧化还原反应呢?
|
反应 |
是否氧化还原反应 |
“得”“失”氧 |
化合价升降 |
氧化还原情况 |
|
C+2CuO=2Cu+CO2 |
|
C 氧 CuO 氧 |
碳元素 铜元素 |
C发生 反应 CuO发生 反应 |
|
2Na+Cl2=2NaCl |
|
|
钠元素 氯元素 |
钠发生 反应 氯气发生 反应 |
氧化还原反应的第二层定义:氧化还原反应是物质有化合价 和 的反应。
氧化反应:物质所含元素化合价 的反应;还原反应:物质所含元素化合价
的反应。判断一个反应是否为氧化还原反应的依据: 。
例题1:下列反应属于氧化还原反应的是 ( )
A、CaCO3+2HCl=CaCl2+H2O+CO2↑ B、CaCO3高温CaO+CO2↑
C、Na2O+H2O=2NaOH D、Mg+2HCl=MgCl2+H2↑
例题2:在反应MnO2+4HCl=MnCl2+2H2O+Cl2↑中, 元素化合价升高,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应; 元素化合价降低,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应。
[讨论3]化学反应的本质是原子间的重新组合。那么氧化还原反应的本质又是什么呢?在反应中为什么会有元素化合价的升降呢?
⑴钠与氯气的反应:2Na+Cl2=2NaCl
Na:化合价 , (得或失)电子,被 ,发生 反应;
Cl:化合价 , (得或失)电子,被 ,发生 反应。
在这个反应中, 是还原剂, 是氧化剂。
⑵氢气与氯气的反应:H2+Cl2=2HCl
H:化合价 ,电子对 ,被 ,发生 反应;
Cl:化合价 ,电子对 ,被 ,发生 反应。
在这个反应中, 是还原剂, 是氧化剂。
氧化还原反应的第三层定义:氧化还原反应是有电子 (得失或 )的反应。
氧化反应表现为被氧化的元素化合价 ,其实质是该元素的原子 (或偏离)电子的过程;还原反应表现为被还原的元素化合价 ,其实质是该元素的原子 (或偏向)电子的过程。氧化还原反应的本质是 。
例题3:下列叙述正确的是 ( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的得失或偏移
[思考]请分析四种基本反应类型的反应与氧化还原反应之间的关系,并试着画出它们之间的交叉分类示意图,然后列举一些具体的化学反应加以说明。
[总结]
|
|
得氧失氧观点 |
化合价升降观点 |
电子转移观点 |
|
氧化反应 |
|
|
|
|
还原反应 |
|
|
|
|
氧化还原反应 |
|
|
|
课后巩固
 2CO2
B、CH4+2O2
2CO2
B、CH4+2O2 CO2+2H2O
CO2+2H2O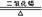 2KCl+3O2↑ D、2Fe(OH)3
2KCl+3O2↑ D、2Fe(OH)3 Fe2O3 +3H2O
Fe2O3 +3H2O  2KCl
+ 3O2↑ ②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
2KCl
+ 3O2↑ ②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 2H2O
2H2O CaO+CO2↑ ⑥Ba(OH)2+H2SO4=BaSO4↓+2H2O
CaO+CO2↑ ⑥Ba(OH)2+H2SO4=BaSO4↓+2H2O 9Fe+4Al2O3
9Fe+4Al2O3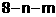
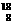 O (2)Ⅷ (3)17 (4)6、7
O (2)Ⅷ (3)17 (4)6、7