30.(11分)碘是人体的必需微量元素之一。加碘食盐中加重主的碘酸钾是一种白色结晶粉末,常温下很稳定。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质反应。
I.工业生产碘碳钾的流程如下:
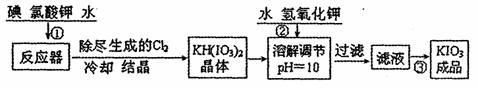
已知步骤①发生反应为6I2+11KclO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
反应中还原剂是 (填化学式),转移电子数为 。
II、已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)检验加碘食物中的碘元素。
学生甲利用碘酸与碘化钾在酸性条件下发生反应,检验是否有碘单质生成所需要的试剂是 ,判断碘单质存在的现象是 ;若要进一步分离提纯碘单质,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量。学生乙设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Ns2S2O3溶液10.0mL,恰好完全反应(I2+2S2O2-3=2I-+S4O2-6)。则加碘食盐样品中的碘元素含量是 mg./kg(以含w的代数式表示)。
(3)有人认为可以用碘化钾代替食盐中的碘酸钾,学生丙又进行了下列实验:
|
操作步骤 |
实验现象 |
|
取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
|
滴入5滴淀粉溶液和1ml0.1mol/L KI溶液,振荡。 |
溶液无变化 |
|
然后再加入少量食醋,振荡。 |
溶液变蓝色 |
根据学生丙的实验结果,回答下列问题
①你认为能否用碘化钾代替食盐中的碘酸钾 (填“能、不能或不确定”)②你认为学生乙的实验结果 (填“偏高、偏低、无影响”)。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答
29.(17分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体。甲烷气体燃烧和水汽化的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ·mol-1
H2O(l)=H2O(g) △H=+44kJ·mol-1
则356g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水,放出的热量为 。
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气体为正极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:正极反应式:
O2+2CO2+4e-=2CO2-3,负极反应式 。
(3)已知一氧化碳与水蒸气的反应为:
 CO(g)+H2O(g) CO2(g)+H2(g)
CO(g)+H2O(g) CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
T℃时物质的浓度(mol/L)变化
|
时间/min |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
0.100 |
0.200 |
0.100 |
0.100 |
|
4 |
0.100 |
0.200 |
0.100 |
0.100 |
|
5 |
0.116 |
0.216 |
0.084 |
c1 |
|
6 |
0.096 |
0.266 |
0.104 |
c2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 。T℃时该化学反应的平衡常数是 。
②已知420℃时,该化学反应的平衡常数为9,如果反应开始时,CO(g)和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为 。
③397℃时,该反应的化学平衡常数为12,请判断该反应的△H 0(填“>、=、<”)。
 (4)燃料电池中产生的CO2气体可以用碱液吸水
(4)燃料电池中产生的CO2气体可以用碱液吸水
得到Na2CO3和NaHCO3。常温下向20mL
28.(14分)I、通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌等金属和少量矿物杂质(与酸不反应)。制作电器及其他仪器产品时必须要求是纯铜,为此以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯。
表:几种物质形成沉淀时的pH
|
物质 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
Cu(OH)2 |
|
开始沉淀时的pH |
7.6 |
2.7 |
5.7 |
4.7 |
|
完全沉淀时的pH |
9.7 |
3.7 |
8.5 |
7.3 |
(1)在精炼铜时,阴极电极反应方程式为 ;金、银以单质的形式沉积在电解槽 (填“阳极”或“阴极”)的槽底。
 (2)在精炼铜的过程中,Cu2+浓度逐渐降低,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学设计了如下除杂流程:
(2)在精炼铜的过程中,Cu2+浓度逐渐降低,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学设计了如下除杂流程:
|
a、氯水 b、高锰酸钾溶液 c、硝酸 d、双氧水
②操作①是 ,根据上表数据分析,除杂方案中能够除去的杂质金属阳离子是 (填化学式)。
II、重金属离子对河流海洋等会造成严重的污染。某化工厂产生的废水(pH=2.0,密度为1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01mol·L-1,排放前拟用沉淀法回收这两种金属,查找有关数据如下:
|
难溶电解质 |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
|
Ksp |
8.3×10-17 |
5.6×10-8 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(1)你认为往废水中投入 (填字母序号)沉淀的效果最好
a、NaOH b、Na2S c、KI d、Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
26.(17分)果蝇是遗传学实验的好材料。
材料一:果蝇野生型和4种突变型的性状表现、控制性状的基因符号和基因所在染色体的编号如下表:
 类型 类型性状 |
甲里生型 |
乙白眼型 |
丙黑身型 |
丁短肢型 |
戊变胸型 |
染色体 |
|
眼色 体色 肢型 后胸 |
红眼W 灰身B 正常肢D 后胸正常H |
白眼w |
黑身b |
短肢d |
后胸变型h |
X(I) II II III |
注:1、每种突变型未列出的性状表现与野生型的性状表现相同。
20.如图所示为一质点作匀变速直线运动的v – t图象,质量
的质量为2kg,质点在前4s内向东运动,则根据图线作
出的以下判断正确的是 ( )
A.质点在8s内始终向东运动
B.质点在8s内的加速度大小不变,方向始终向西
C.质点在8s内的加速度大小不变,方向先向西后向东
D.在8s内合外力对质点做的功为200J
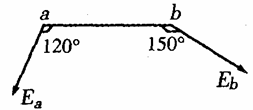 21.如图所示为真空中某一点电荷Q产生的电场,a、b分别是其电场中的两点,其中a点的场强大小为Ea,方向与a、b连线成120°角;b点的场强大小为Eb,方向与a、b连线成150°角。则关于a、b两点的场强大小及电势高低的说法正确的是 ( )
21.如图所示为真空中某一点电荷Q产生的电场,a、b分别是其电场中的两点,其中a点的场强大小为Ea,方向与a、b连线成120°角;b点的场强大小为Eb,方向与a、b连线成150°角。则关于a、b两点的场强大小及电势高低的说法正确的是 ( )
A.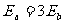 B.
B.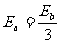
C. D.
D.
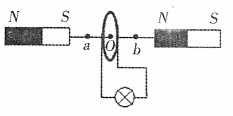 22.某同学在学习了法拉第电磁感应定律之后,自己
22.某同学在学习了法拉第电磁感应定律之后,自己
制作了一个手动手电筒,下图是该手电筒的简单
结构示意图,左右两端是两块完全相同的条形磁
铁,通过一根绝缘直杆相连,由绝缘细铜丝绕制
的多匝环形线圈只可在直杆上左右自由滑动,线
圈两端接一灯泡,晃动手电筒时线圈也来回滑动,
灯泡就会发光,其中O点是两磁极连线的中点,a、b两点是线圈运动经过的两点,且关于O点对称,则下列说法正确的是 ( )
A.线圈经过O点时穿过的磁通量最大
B.线圈经过O点时穿到的磁场力最大
C.线圈沿不同方向经过b点时所受的磁场力方向相反
D.线圈沿同一方向经过a、b两点时其中的电流方向相同
第Ⅱ卷(必做120分+选做32分,共152分)
|
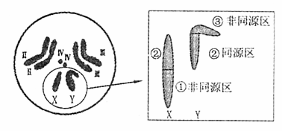 材料二:如右图所示,X染色体和Y染色体大小、形态不完全相同,存在着同源区(②)和非同源区(①、③)。
材料二:如右图所示,X染色体和Y染色体大小、形态不完全相同,存在着同源区(②)和非同源区(①、③)。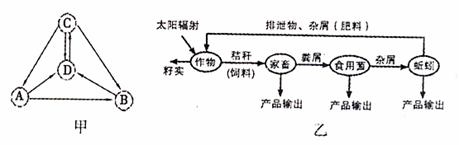 27.(16分)图甲是生态系统各种成分关系示意图,图乙是生态农业的模式图,请据图回答下列问题:
27.(16分)图甲是生态系统各种成分关系示意图,图乙是生态农业的模式图,请据图回答下列问题: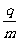 =2×108C/kg的正电荷从坐标为(0,-l)的A点处由静止释放,电荷以一定的速度沿直线AC运动并从坐标为(1,0)的C点第一次经x轴进入区域一,经过一段时间,从坐标原点D再次回到区域二。
=2×108C/kg的正电荷从坐标为(0,-l)的A点处由静止释放,电荷以一定的速度沿直线AC运动并从坐标为(1,0)的C点第一次经x轴进入区域一,经过一段时间,从坐标原点D再次回到区域二。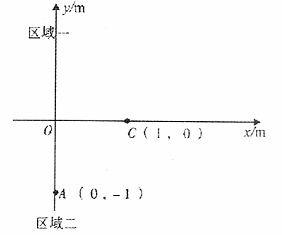
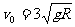 的初速度由A点开始向B点滑行,并滑上半径为R的光滑的
的初速度由A点开始向B点滑行,并滑上半径为R的光滑的 圆弧BC,AB=5R。在C点正上方有一离C点高度也为R的旋转平台,沿平台直径方向开有两个离轴心距离相等的小孔P、Q,旋转时两孔均能达到C点的正上方。若滑块滑过C点后竖直向上穿过P孔,又恰能从Q孔落下,则平台转动的角速度ω应满足什么条件?(重力加速度为g)
圆弧BC,AB=5R。在C点正上方有一离C点高度也为R的旋转平台,沿平台直径方向开有两个离轴心距离相等的小孔P、Q,旋转时两孔均能达到C点的正上方。若滑块滑过C点后竖直向上穿过P孔,又恰能从Q孔落下,则平台转动的角速度ω应满足什么条件?(重力加速度为g)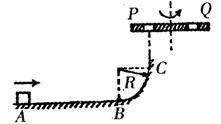
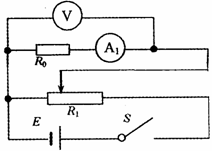 23.(12分)某课题研究小组,收集了数码相机、手机等用旧了各种类型的电池,及从废旧收音机上拆下的电阻、电容、电感线圈。现从这些材料中选取两个待测元件:一是电阻R0(约为2kΩ),二是手机中常用的锂电池(电动势E标称值为3.7V,允许最大放电电流为100mA)。在操作台上还准备了如下实验器材:
23.(12分)某课题研究小组,收集了数码相机、手机等用旧了各种类型的电池,及从废旧收音机上拆下的电阻、电容、电感线圈。现从这些材料中选取两个待测元件:一是电阻R0(约为2kΩ),二是手机中常用的锂电池(电动势E标称值为3.7V,允许最大放电电流为100mA)。在操作台上还准备了如下实验器材: