28.(共15分)
铁是一种历史悠久、应用最广泛、用量最大的金属。某实验小组用铁进行如下实验:
(1)取少量纯铁粉与足量的稀H2SO4反应,在不影响产生H2总量的情况下,若要加快反应速率,可行的方法有(填序号) 。
①加热 ②滴加少量浓HNO3 ③滴加少量CuSO4溶液
(2)甲同学欲用少量纯铁粉与足量浓H2SO4在加热时反应制得FeSO4。同学们认为不可行,理由是 。
 大家讨论后将上述方案做如下改进后可获得FeSO4·7H2O。请填写空白:
大家讨论后将上述方案做如下改进后可获得FeSO4·7H2O。请填写空白:
(3)乙同学用mg废铁屑(已除去表面油污)与足量稀H2SO4反应,准确测定反应生成的H2的体积,实验数据记录如下:
|
气体体积/mL |
10 |
20 |
30 |
|
所用时间/s |
30 |
85 |
165 |
若用每秒产生的气体体积(mL)表示该反应的速率,则30s至85s内该反应的速率为 。完全反应后测得产生气体的体积为VmL(已折算成标准状况),则该废铁屑中铁的质量分数为(用含m、V的代数式表示) 。
若实验操作无误,但测得铁的质量分数总是大于实际值,原因可能是 。
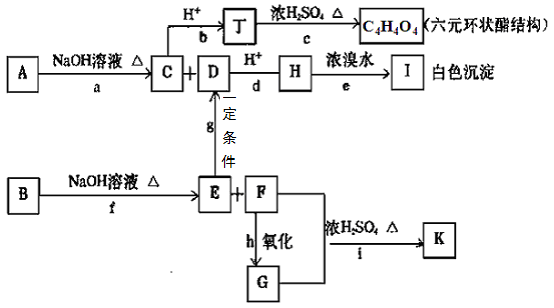
27.(16分)
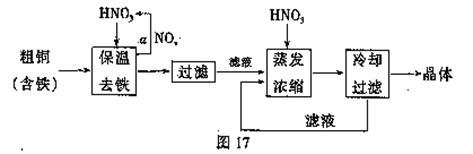 (1)工业上以粗铜为原料采取如图17所示流程制备硝酸铜晶体。
(1)工业上以粗铜为原料采取如图17所示流程制备硝酸铜晶体。
①步骤a中,还需要通入氧气和水,其目的是 。
②根据下表数据,在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化开始沉淀时pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的主要原因是 。
 ③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其原因是(结合离子方程式说明)
。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其原因是(结合离子方程式说明)
。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时
阴极反应式是 。
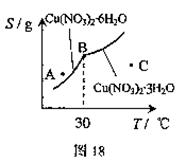
(3)图18是某小组同学查阅资料所绘出的硝酸
铜晶体[Cu(NO3)2·nH2O]的溶解度曲线
(温度在30℃前后对应不同的晶体),下
列说法正确的是 (填字母)。
a.A点时溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程终得到晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是
。
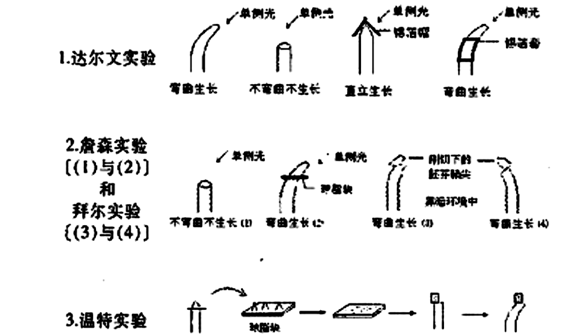
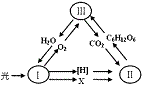 2.右图为绿色植物体内某些代谢过程中物质变化的示意图,Ⅰ 、Ⅱ、Ⅲ分别表示不同代谢过程。以下叙述不正确的是
( )
2.右图为绿色植物体内某些代谢过程中物质变化的示意图,Ⅰ 、Ⅱ、Ⅲ分别表示不同代谢过程。以下叙述不正确的是
( )
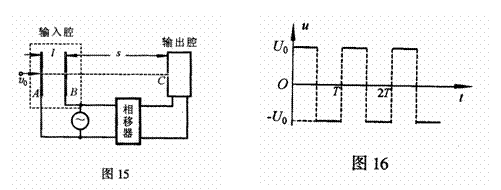 (3)在上述速度分别为v1和v2的电子中,若t时刻经过B板射出的速度为v1的电子总能与
(3)在上述速度分别为v1和v2的电子中,若t时刻经过B板射出的速度为v1的电子总能与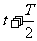 时刻经B板射出的速度为v2的电子同时进入输出腔,则可通过相移器的控制将电子的动能转化为输出腔中的电场能,从而实现对甚高频信号进行放大的作用。为实现上述过程,输出腔的C孔到输入腔的右极板B的距离s应满足什么条件?
时刻经B板射出的速度为v2的电子同时进入输出腔,则可通过相移器的控制将电子的动能转化为输出腔中的电场能,从而实现对甚高频信号进行放大的作用。为实现上述过程,输出腔的C孔到输入腔的右极板B的距离s应满足什么条件?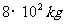 的电动车由静止开始沿平直公路行驶,达到的最大速度为15m/s,利用传感器测得此过程中不同时刻电动车的牵引力F与对应的速度
的电动车由静止开始沿平直公路行驶,达到的最大速度为15m/s,利用传感器测得此过程中不同时刻电动车的牵引力F与对应的速度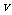 ,并描绘出
,并描绘出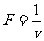 图象(图中AB、BO均为直线)。假设电动车行驶中所受到的阻力恒定,求:
图象(图中AB、BO均为直线)。假设电动车行驶中所受到的阻力恒定,求: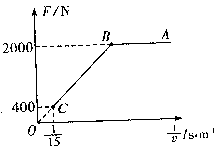
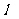 表示。电子运动的平均速度用
表示。电子运动的平均速度用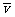 表示,导体单位体积内自由电子的数量为n,电子的质量为
表示,导体单位体积内自由电子的数量为n,电子的质量为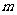 ,电子的电荷量为
,电子的电荷量为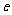 ,电流的表达式I=nes
,电流的表达式I=nes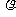 =
=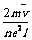 。
。