高二第二学期期中化学考试 学科网
学科网
一、单项选择题(本题包括16小题,每小题2分,共32分) 学科网
学科网
1.下列说法正确的是( )
 学科网
学科网
A.化学反应不一定有分子碰撞 学科网
学科网
B.发生有效碰撞的分子是活化分子 学科网
学科网
C.凡是放热反应都是自发的,吸热反应都是非自发的 学科网
学科网
D.自发反应一定是熵增大,非自发反应一定是熵减少或不变 学科网
学科网
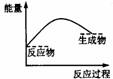 2.下列各图中,表示正反应是吸热反应的是( )
2.下列各图中,表示正反应是吸热反应的是( ) 学科网
学科网
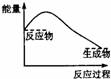
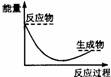
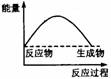
 学科网
学科网
 学科网
学科网
 学科网
学科网
 学科网
学科网
 学科网
学科网
 A
B
C
D
A
B
C
D 学科网
学科网
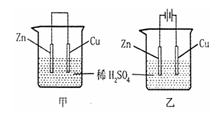
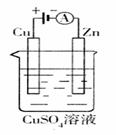
3.关于如图所示装置的叙述正确的是( )  学科网
学科网
A.甲乙装置中的锌片都作负极 学科网
学科网
B.甲乙装置中的溶液内的H+都是在铜片上被还原 学科网
学科网
C.甲乙装置中锌片上发生的反应都是还原反应 学科网
学科网
D.甲装置中铜片上有气泡生成,乙装置中的铜片质量减小
4.
在298K、1.01×105Pa下,将 学科网
学科网
A.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJ?mol―1 学科网
学科网
B.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2x-y)kJ?mol―1 学科网
学科网
C.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y)kJ?mol―1 学科网
学科网
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) △H=-(8x-y)kJ?mol―1 学科网
学科网
5.下列事实中,不能用勒沙特列原理解释的是( ) 学科网
学科网
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫 学科网
学科网
B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化 学科网
学科网
C.实验室中常用排饱和食盐水的方法收集Cl2 学科网
学科网
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 学科网
学科网
6.0.1 mol?L-1盐酸分别跟20 mL NaOH溶液和20mL氨水完全反应,都消耗了20 mL盐酸,这表明NaOH溶液和氨水的关系( )  学科网
学科网
A.物质的量浓度相同
B.氢氧根离子浓度相同  学科网
学科网
C.都是强电解质
D.溶液中氢离子浓度相同 学科网
学科网
7.四位同学同时进行反应:A(g)+3B(g)= 学科网
学科网
 A.① B.②
C.③
D.④
A.① B.②
C.③
D.④
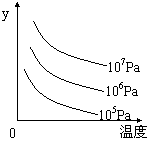
8.有如下的可逆反应:X(g)+2Y(g)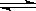 2Z(g) 现将X和Y以1┱2的体积比混合在密闭容器中,加压到3×107帕,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是( )
2Z(g) 现将X和Y以1┱2的体积比混合在密闭容器中,加压到3×107帕,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是( )  学科网
学科网
A. 学科网
学科网
9.在一定温度下的定容密闭容器中,下列说法能表明反应:A(s)+2B(g)  C(g)+D(g)已达平衡的是
( )
C(g)+D(g)已达平衡的是
( ) 学科网
学科网
A.混合气体的压强不变 B.消耗2molB的同时生成1molC  学科网
学科网
C.混合气体的相对分子质量不变 D.气体的总物质的量不变 学科网
学科网
10.一个真空密闭恒容容器中盛有1molPCl5,加热到 学科网
学科网
PCl5(g)  PCl3 (g)+Cl2 (g) ,反应达到平衡时,混合气体中PCl5所占体积分数为M%,。若同一温度的同一容器中,最初投入2 molPCl5,反应达平衡时,混合气体中PCl5所占体积分数为N%。则M和N的关系是( )
PCl3 (g)+Cl2 (g) ,反应达到平衡时,混合气体中PCl5所占体积分数为M%,。若同一温度的同一容器中,最初投入2 molPCl5,反应达平衡时,混合气体中PCl5所占体积分数为N%。则M和N的关系是( )
A.M>N B.M=N C.M<N
D.无法确定 学科网
学科网
11.一定温度下,某密闭容器里发生如下反应:CO(g) + H2O(g) CO2(g)
+ H2(g)(正反应为吸热反应),当反应达到平衡时,测量容器中各物质的物质的量均为n mol,欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中可采用的是( )。
CO2(g)
+ H2(g)(正反应为吸热反应),当反应达到平衡时,测量容器中各物质的物质的量均为n mol,欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中可采用的是( )。 学科网
学科网
 ①升高温度 ②增大压强 ③再通入n mol CO2和n mol H2
①升高温度 ②增大压强 ③再通入n mol CO2和n mol H2  学科网
学科网
 ④再加入2n mol CO和2n mol H2O(g)
④再加入2n mol CO和2n mol H2O(g) 学科网
学科网
 A.①② B.②④ C.③④ D.①②③
A.①② B.②④ C.③④ D.①②③ 学科网
学科网
12.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( ) 学科网
学科网
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e― == Ni 学科网
学科网
B.电解过程中,阳极质量的减少与阴极质量的增加相等 学科网
学科网
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ 学科网
学科网
 D.电解后,电解槽底部的阳极泥中只有Cu和Pt
D.电解后,电解槽底部的阳极泥中只有Cu和Pt  学科网
学科网
13.某可逆反应L (s)+G(g)  3R(g);ΔH>0。右图表示外界条件,即温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
3R(g);ΔH>0。右图表示外界条件,即温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( ) 学科网
学科网
A.平衡混合气中R的质量分数 学科网
学科网
B.达到平衡时G的转化率 学科网
学科网
C.平衡混合气中G的质量分数 学科网
学科网
D.达到平衡时L的转化率 学科网
学科网
14.用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,该电池放电时的总反应为:CH4+2KOH+2O2==K2CO3+3H2O,下列说法错误的是( )
A.通甲烷的一极为负极,通氧气的一极为正极 学科网
学科网
B.放电时通入氧气的一极附近溶液的pH升高 学科网
学科网
C.放电一段时间后,KOH的物质的量会发生变化 学科网
学科网
 D.通甲烷的电极反应式是:CH4+10OH―+8e―==CO32―+7H2O
D.通甲烷的电极反应式是:CH4+10OH―+8e―==CO32―+7H2O
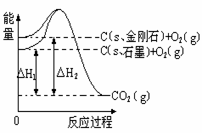
15.如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是( ) 学科网
学科网
A.C(s、石墨)== C(s、金刚石)
△H=
+1.9 kJ•mol-1 学科网
学科网
B.石墨和金刚石的转化是物理变化 学科网
学科网
C.金刚石的稳定性强于石墨 学科网
学科网
D.1
mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ 学科网
学科网
16.醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) 学科网
学科网
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 学科网
学科网
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 学科网
学科网
D.升高温度,醋酸溶液的pH值变小 学科网
学科网
二、单项选择题(本题包括8小题,每小题3分,共24分) 学科网
学科网
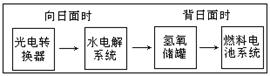
17.下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( ) 学科网
学科网
 学科网
学科网
A.该能量转化系统中的水也是可以循环利用的 学科网
学科网
B.燃料电池系统产生的能量实际上来自于太阳能 学科网
学科网
C.水电解系统中的阳极反应:4OH--4e - =2H2O+O2↑ 学科网
学科网
D.燃料电池放电时的负极反应:H2-2e ―=2H+ 学科网
学科网
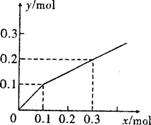 18.以Pt为电极,电解含有0.10mol
M+和0.10mol N3+
(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)( )
18.以Pt为电极,电解含有0.10mol
M+和0.10mol N3+
(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)( ) 学科网
学科网
A.M+ > H+ > N3+ 学科网
学科网
B.M+ >N3+ > H+ 学科网
学科网
C.N3+ >H+ > M+ 学科网
学科网
D.条件不足,无法确定 学科网
学科网
19.现已知:2H2(g)+O2(g)=2H2O(l),ㄓH=-572kJ/mol;H―H键的键能为436kJ/mol;O=O键的键能为498kJ/mol,则H2O分子中O―H键的键能为( ) 学科网
学科网
A.485.5 kJ/mol B.610 kJ/mol C.917 kJ/mol D.1220 kJ/mol 学科网
学科网
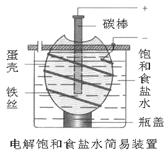 20.右图为电解饱和食盐水的简易装置,下列有关说法正确的是( )
20.右图为电解饱和食盐水的简易装置,下列有关说法正确的是( ) 学科网
学科网
A.电解一段时间后,往蛋壳内溶液中滴加几滴酚酞,呈红色B.蛋壳表面缠绕的铁丝发生氧化反应。 学科网
学科网
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝。 学科网
学科网
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触. 学科网
学科网
21.在一定条件下,将物质的量相同的NO和O2混和,发生如下反应:2NO+O2=2NO2,2NO2 N2O4,所得混合气体中NO2的体积百分含量为40%,此时,混合气体的平均分子量为( )
N2O4,所得混合气体中NO2的体积百分含量为40%,此时,混合气体的平均分子量为( )
 学科网
学科网
A.49.6 B. 学科网
学科网
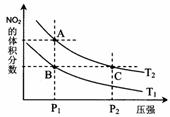 22.反应N2O4(g)
22.反应N2O4(g) 2NO2(g);△H= +57 kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);△H= +57 kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( ) 学科网
学科网
A.A、C两点的反应速率:A>C 学科网
学科网
B.A、C两点气体的颜色:A深,C浅 学科网
学科网
C.由状态B到状态A,可以用加热的方法 学科网
学科网
D.A、C两点气体的平均相对分子质量:A>C 学科网
学科网
23.在一个固定体积的密闭容器中,放入 2Q(g)+nR(g) 达到平衡后,容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小1/3,则该反应式中的n值是( )
2Q(g)+nR(g) 达到平衡后,容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小1/3,则该反应式中的n值是( )
 学科网
学科网
A.3 B. 学科网
学科网
24.
一定温度下,向一个一定容积的密闭容器中放入2molX和3molY,发生反应:X(气)+Y(气)  mZ(气)+nR(气),达平衡时,Z的体积分数为φ1,维持温度不变,若把3 molX和2molY放入另一体积相同的密闭容器,达平衡时,Z的体积分数为φ2,则φ1与φ 2的关系为( )
mZ(气)+nR(气),达平衡时,Z的体积分数为φ1,维持温度不变,若把3 molX和2molY放入另一体积相同的密闭容器,达平衡时,Z的体积分数为φ2,则φ1与φ 2的关系为( )
A.φ1>φ2
B.φ1<φ 学科网
学科网
三、填空题
25.(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ
(
(2)肼―空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH
 溶液。肼―空气燃料电池放电时:
溶液。肼―空气燃料电池放电时:
正极的电极反应式是
(3)右图是一个电化学过程示意图。
假设使用肼―空气燃料电池作为本过程中的电源,铜
片的质量变化为
耗标准状况下的空气 L(假设空气中氧气体
积含量为20%)
26.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
 ① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
⑴Z2Y的化学式是 ,
⑵Z2Y2与X2Y反应的化学方程式是 。
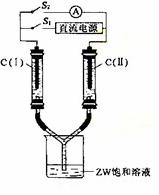
⑶如图所示装置,两玻璃管中盛满滴有酚酞的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1 后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是 (填写正极或负极);
C(Ⅱ)的电极反应式是 。
⑷铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是:
27.工业制硫酸的核心反应是
:2SO2(g)+ O2(g) 2SO3(g)
ΔH<0,回答下列问题:
2SO3(g)
ΔH<0,回答下列问题:
(1)此反应的平衡常数表达式为K=_______________,随着温度的升高,上述平衡常数_______(填“增大”、“减小”或“不变”)。
(2)将一定量的SO2(g)和O2(g)放入
(3)体积不变的条件下,下列措施中有利于提高SO2的转化率的是_____________(填字母)。
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(4)工业制硫酸的尾气中含有少量SO2 ,可用氨水吸收。
反应的化学方程式为________________________________。
28.向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
N2(气)+ 3 H2(气) 2
NH3(气),平衡时混合气共7
mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2
NH3(气),平衡时混合气共7
mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
(1)若a=0,b=0,则c= .
(2)若a=0.7,b=2.1,则:
Ⅰ.c= .
Ⅱ.这时反应向 进行.
Ⅲ.若要维持反应开始向该反应方向进行,c的范围是 .
(3)欲使起始反应维持向与②相反的方向进行,则b的范围是 .
四、计算题
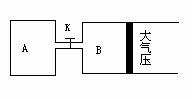 29.如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)
29.如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=
(1)B中X 的转化率α(X)B为
(2)A中W和B中Z的物质的量的比较:
n(W)A n(Z)B (填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为 升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是
高二化学期中答卷
班级______________ 考号______________ 姓名______________
选择题全部涂在答题卡上
三、填空题
25.(1)
(2)
(3)
26.(1)
(2)
(3)
(4)
27.(1)____________________________ ,______________
(2)______________
(3)______________
(4)______________________________________________________________________
28.(1)______________
(2)______________,______________,______________
(3)______________
四、计算题
29.(1)______________
(2)______________
(3)______________
(4)______________________________________________________________________
 高二化学期中答案
高二化学期中答案