摘要:25.(1)肼(N2H4)又称联氨.是一种可燃性的液体.可用作火箭燃料.
网址:http://m.1010jiajiao.com/timu_id_114402[举报]
 肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料.(1)写出肼与一氧化氮反应的化学方程式
N2H4+2NO=2N2+2H2O
N2H4+2NO=2N2+2H2O
.(2)肼--空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,电极反应式:负极
N2H4+4OH--4e-=N2+4H2O
N2H4+4OH--4e-=N2+4H2O
.(3)如图是一个电化学装置示意图.用肼--空气燃料电池做此装置的电源.
①如果A为含有铁、银、金、碳等杂质的粗铜,B为纯铜,C为CuSO4溶液.通电一段时间后,
阴
阴
极的质量增大.(填“阴极”、“阳极”).②如果A是铂电极,B是石墨电极,C是CuSO4溶液,阳极的电极反应式是
2H2O-4e-=O2+4H+(或4OH--4e-=O2+2H2O)
2H2O-4e-=O2+4H+(或4OH--4e-=O2+2H2O)
.若产生1mol气体则消耗肼为32
32
g.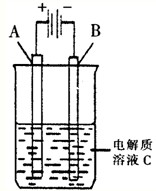 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol
则32g肼完全燃烧得到气态产物时放出热量
534
534
kJ.(2)肼--空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,正极的电极反应式是
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
,电池工作一段时间后,电解质溶液的pH将减小
减小
(填“增大”、“减小”、“不变”).(3)如图是一个电化学装置示意图.用肼--空气燃料电池做此装置的电源.
①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4.该装置的实际意义是
精炼粗铜
精炼粗铜
.②如果A是铂电极,B是石墨电极,C是AgNO3溶液,电解的离子方程式为
4AgNO3+2H2O
4Ag+4HNO3+O2↑
| ||
4AgNO3+2H2O
4Ag+4HNO3+O2↑
,若
| ||
B
B
极(填A或B)增重10.8g,该燃料电池理论上消耗0.025mol
0.025mol
molN2H4. 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.(1)已知在25℃,101kPa时,16.0g N2H4在氧气中完全燃烧生成氮气,放出热量312kJ,N2H4完全燃烧反应的热化学方程式是
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2
N2H4+4OH--4e-=4H2O+N2
.电池工作一段时间后,电解质溶液的pH将减小
减小
(填“增大”、“减小”、“不变”).(2)如图是一个电化学装置示意图.用肼--空气燃料电池做此装置的电源.如果A是铂电极,B是石墨电极,C是500mL足量的饱和氯化钠溶液,当两极共产生1.12L气体时,溶液的pH为
13
13
,则肼-空气燃料电池理论上消耗的空气1.4
1.4
L(气体体积在标准状况下测定,假设空气中氧气体积分数为20%)(3)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因
N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-
N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-
.(4)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4?H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)
大于
大于
0.1mol/L HCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”).(5)已知:在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+离子浓度由大到小的顺序为
c(N2H5+)>c(Cl-)>c(OH-)>c(H+)
c(N2H5+)>c(Cl-)>c(OH-)>c(H+)
.肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
(1)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,通入肼的一极为
(2)肼用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977.写出肼与亚硝酸反应的化学方程式
(3)肼和四氧化二氮作火箭推进剂,两者反应产物是氮气和水.当反应生成28.0kg还原产物时,计算参加反应的肼的质量 (写出计算过程)
查看习题详情和答案>>
(1)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,通入肼的一极为
负极
负极
极,该极的电极反应式是N2H4-4e-+4OH-=N2 ↑+4H2O
N2H4-4e-+4OH-=N2 ↑+4H2O
,电池工作一段时间后,电解质溶液的pH将减小
减小
(填“增大”、“减小”、“不变”).(2)肼用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977.写出肼与亚硝酸反应的化学方程式
N2H4+HNO2=NH3+2H2O
N2H4+HNO2=NH3+2H2O
.(3)肼和四氧化二氮作火箭推进剂,两者反应产物是氮气和水.当反应生成28.0kg还原产物时,计算参加反应的肼的质量 (写出计算过程)
64kg
64kg
. 肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料.