摘要:B.A.C两点气体的颜色:A深.C浅学科网
网址:http://m.1010jiajiao.com/timu_id_114395[举报]
A、B、C、D、E、F均为短周期元素,其原子序数依次增大.已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素.根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是
(5)已知:2CD2(g)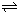 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
①a、b、c、d四个点中,化学反应处于平衡状态的是
②25min时,增加了
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
查看习题详情和答案>>
(1)B与D形成化合物BD2的结构式为
O═C═O
O═C═O
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
H++HSO3-═SO2↑+H2O
H++HSO3-═SO2↑+H2O
;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-CO32-+H2O HCO3-+OH-
HCO3-+OH-
. HCO3-+OH-
HCO3-+OH-(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.(5)已知:2CD2(g)
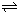 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
①a、b、c、d四个点中,化学反应处于平衡状态的是
bd
bd
点.②25min时,增加了
NO2
NO2
(填物质的化学式)0.8
0.8
mol.③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
cdba
cdba
(填字母).反应N2O4(g ) 2NO2(g);ΔH=+57kJ·mol-1,在温度为T1、T2,平衡体系中NO2体积分数随压强变化的曲线如下图所示。下列说法正确的是
2NO2(g);ΔH=+57kJ·mol-1,在温度为T1、T2,平衡体系中NO2体积分数随压强变化的曲线如下图所示。下列说法正确的是
 2NO2(g);ΔH=+57kJ·mol-1,在温度为T1、T2,平衡体系中NO2体积分数随压强变化的曲线如下图所示。下列说法正确的是
2NO2(g);ΔH=+57kJ·mol-1,在温度为T1、T2,平衡体系中NO2体积分数随压强变化的曲线如下图所示。下列说法正确的是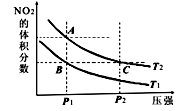
[ ]
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B<C
查看习题详情和答案>>
B.A、C两点气体的颜色:A深,C浅
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B<C
 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示.(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是
X
X
;a、b、c、d四个点中,表示化学反应处于平衡状态的点是b、d
b、d
.(2)①前10min内用NO2表示的化学反应速率v(NO2)=
0.04
0.04
mol?L-1?min-1.②反应2NO2(g)?N2O4(g)在b点的平衡常数K(b)=
| 10 |
| 9 |
| 10 |
| 9 |
③反应2NO2(g)?N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:K(d)
=
=
K(b)(填“>”、“=”或“<”).(3)①据图分析,在25min时采取的措施是
C
C
(填序号).A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35min时,保持温度不变,快速缩小容器的体积至1L,气体的颜色变化过程是
先变深后变浅,但比原平衡颜色深
先变深后变浅,但比原平衡颜色深
.下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语或符号回答下列问题:
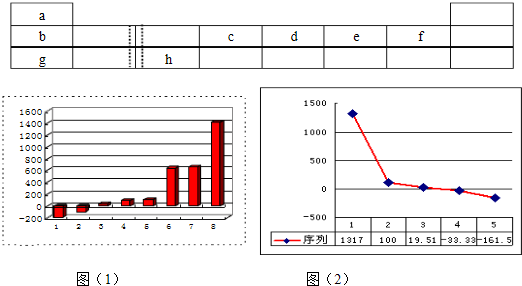
(1)上图(1)是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是
(2)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(2),序列“5”的氢化物的名称是
 .
.
(3)e元素与f元素相比,电负性f大于e,下列表述中能证明这一事实的是
A.常温下f单质的颜色比e单质的颜色深
B.f单质与e的氢化物剧烈反应,产生e的单质
C.f与e形成的化合物中e元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,请写出你认为正确的Al2Cl6结构是
 .
.
(5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是
A.钠晶胞结构如右图,钠晶胞中每个钠原子的配位数为6
B.钠晶胞结构如右图,晶胞中分摊2个钠原子
C.氮的电负性大于氧
D.Na+的半径小于N3-的半径.
查看习题详情和答案>>

(1)上图(1)是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是
原子
原子
晶体(填晶体的类型).(2)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(2),序列“5”的氢化物的名称是
甲烷
甲烷
,序列“2”的氢化物的结构式为

(3)e元素与f元素相比,电负性f大于e,下列表述中能证明这一事实的是
BC
BC
(填选项序号)A.常温下f单质的颜色比e单质的颜色深
B.f单质与e的氢化物剧烈反应,产生e的单质
C.f与e形成的化合物中e元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,请写出你认为正确的Al2Cl6结构是



(5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是
BD
BD
(选填序号)A.钠晶胞结构如右图,钠晶胞中每个钠原子的配位数为6
B.钠晶胞结构如右图,晶胞中分摊2个钠原子
C.氮的电负性大于氧
D.Na+的半径小于N3-的半径.
| |||||||||||||||||||||||