2007-2008学年度江苏省秋实学苑期中考试
化学试卷
本试卷分选择题和非选择题两部分,满分120分。考试时间100分钟。
可能用到的相对原子质量:H
I卷选择题(共57分)
一、选择题(本题包括10小题,每小题3分,共30分,每小题只有一个选项符合题意)
1.自然界里常见金属元素存在最多的是Al,其次是铁,铜的含量较少。然而人类冶炼金属获得成功最早的反而是含量少的铜,含量最多的铝最迟冶炼出来。金属是当今社会最不可缺少的材料之一。下列有关金属的说法不正确的是 ( )
A.铜比铝先获得成功冶炼原因是,铜矿较易还原,铝矿很难还原。
B.目前已制得的纯金属只有90多种,但制得的合金已达几千种,大量使用的不是纯金属而是它们的合金。
C.生铁易生锈不耐蚀,但纯铁具有耐蚀性,所以不锈钢应是最纯的铁。
D.废弃铝质包装既浪费金属材料又造成环境污染
2.利用新技术能将不锈钢加工成柔软的金属丝,它可以和棉纤维一起编织成为防辐射的劳防服装,这是利用了金属的
A.耐腐蚀性 B.还原牲 C.热传导性 D.延展性
3.环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是 ( )
A.温室效应――二氧化碳 B.光化学污染――二氧化氮
C.酸雨――二氧化碳 D.臭氧层破坏――氟氯烃
4.小华家中有如下生活用品:碘酒、食盐、食醋、84消毒液(内含NaClO),小华利用上述用品不能完成的任务是
A.检验买来的奶粉中是否加有淀粉 B.检验自来水中是否含有Cl-
C.除去保温瓶中的水垢 D.洗去白色衣服上的番茄汁
5.“空对空”响尾蛇导弹头部的“红外眼睛”,能分辩出
A.“红外眼睛”对热非常敏
B.“红外眼睛”的热目标是敌机发动机或尾部喷口高温区
C.“红外眼睛”的电阻值随温度明显变化
D.“红外眼睛”的工作原理与人眼相同
6.通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,能加快化学反应速率的是

A B C D
7.下面有关硅的叙述中,正确的是( )
A.光导纤维是以硅酸盐为主要原料制成的
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是最重要的半导体材料
8.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
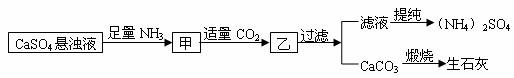
下列推断不合理的是 ( )
A.直接蒸干滤液得到纯净的(NH4)2SO4
B.生成1mol(NH4)2SO4至少消耗2molNH3
C.CO2可被循环使用
D.往甲中通CO2有利于(NH4)2SO4生成
9.泽维尔用飞秒(时间单位:1飞秒=10-15秒)激光技术研究了氰化碘(ICN)的分解反应ICN→I++CN-,发现该变化可在200飞秒内完成。已知(CN)2和卤素的性质相似。以下有关ICN的叙述中正确的是( )
A.ICN不能和NaOH溶液反应 B.ICN是一种共价化合物
C.将ICN加入到氯水中可生成I2 D.ICN的晶体是离子晶体
10.一些盐的结晶水合物,在温度不太高时就有熔化现象,即熔溶于自身的结晶水中,又同时吸收热量。它们在塑料袋中经日晒就熔化,又在日后缓慢凝结而释放热量。故可用于调节室内的温度,或作夏日防暑用枕垫或座垫,这些物质可称之为潜热材料。现有几种盐的结晶水合物有关数据如下:


①
②
③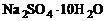
④
熔点(℃)
40~50
29.92
32.38
35.1
溶化热
(kJ?mol-1)
49.7
37.3
77
100.1
根据上述数据,实际应用时最常采用的(由来源和成本考虑)应该是
A.① B.② C.③ D.④
二、选择题(本题共9小题,每小题3分,共27分。每小题有一或两个选项符合题意)
11.蛇纹石由MgO、A12O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3,
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
12.下列离子方程式,正确的是
( )
A.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合
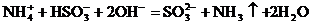
B.碳酸钠溶液中加入二氧化硅:CO32- +SiO2==SiO32- +CO2↑
C.二氧化硅与烧碱溶液反应:SiO2 +2OH- === SiO32-+H2O
D.硅酸与烧碱溶液中和:H2SiO3 +2OH- === SiO32-+2H2O
13.某同学用一小块铝片和盐酸反应制取H2,实验现象如下表:
时间
1 min
2 min
5 min
15 min
20 min
现象
少量气泡
较多气泡
大量气泡
反应剧烈
铝片耗尽
反应1~15min内,铝与盐酸的反应速率变化的可能原因是 ( )
A.该反应是放热反应,温度升高 B.反应过程中盐酸的浓度增大
C.随着反应的进行,铝片表面积变小 D.Cl-离子是该反应的催化剂
14.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.
B.
C.6.4 gS6与S8的混合物中所含S原子数一定为0.2 NA
D.标准状况下,
15.实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为lmol?L-1。下面四个选项中能达到此目的的是( )
A.NH4+、Na+、NO3-、Cl- B.Cu2+、K+、SO42―、NO3―
C.H+、K+、HCO3-、Cl― D.Mg2+、Na+、Cl―、SO42―
16.已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下 ( )
加入试剂
稀硫酸
浓硫酸、加热
稀硝酸
浓硝酸
实验现象
红色固体
和蓝色溶液
无色气体
无色气体
和蓝色溶液
红棕色气体
和绿色溶液
由此推出本次氢气还原氧化铜实验的产物是
A.Cu B.Cu2O
C.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu
17.t℃时CuSO4的溶解度是S g,其饱和溶液密度d g.cm-3、物质的量浓度为c mol.L-1。向足量饱和溶液中加入m g无水CuSO4或蒸发掉n g水后恢复t℃,均能获得W g胆矾晶体,下列关系式正确的是( )
A. B.
B.
C.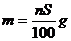 D.
D.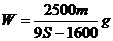
18.有
A.肯定含①③,不含② B.肯定含①③,可能含②
C.肯定含②③,不含① D.肯定含②③,可能含①
19.某学生用NaHCO3,和KHCO3,组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
50mL 盐酸
50mL 盐酸
50mL 盐酸
m(混合物)
V(CO2)(标况)
则下列分析推理中不正确的是
A.盐酸的物质的量浓度为3.0mol?L
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物
D.
|


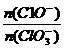 将 2(填“>”“<”或“=”);若
将 2(填“>”“<”或“=”);若
 该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是
。
该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是
。