苏州市2006届高三教学调研测试
化 学
注意事项:
可能用到的相对原子质量:H
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)。
1. 下列解释不合理的是
A.“水滴石穿”是溶解了CO2的雨水长期与CaCO3的作用生成了Ca(HCO3)2之故
B.长期盛放NaOH溶液的滴瓶不易打开,主要是因为NaOH吸收了CO2所致
C.实验室用“通风橱”是一种不彻底的排放手段,因有害气体未经转化或吸收
D.“雨后彩虹”、“海市蜃楼”这类自然景观不仅与光现象有关也与胶体有关
2.实验室利用双氧水制取并收集氧气时,必须使用的常见仪器是
A.天平 B.量筒 C.导管 D.烧杯
3.2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,却能在氧气中燃烧,下列有关硫化羰的说法正确的是
A.硫化羰可用作灭火剂
B.CO2和COS都是非极性分子
C.硫化羰的熔点可能比二氧化碳的熔点低
D.1 mol硫化羰在氧气中充分燃烧时转移6 mol电子
4.下列物质不能通过化合反应得到的是
A.Fe(OH)3 B.FeCl
5.某同学在所收到的信封上发现有收藏价值的邮票,便将邮票剪下来浸入水中,以去掉邮票背面的黏合剂。根据“相似相溶”原理,该黏合剂的成分可能是
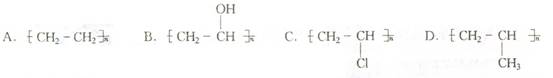
6.已知某饱和溶液的以下条件:①溶液的质量 ②溶剂的质量 ③溶液的体积 ④溶质的摩尔质量 ⑤溶质的溶解度 ⑥溶液的密度,其中不能用来计算该饱和溶液的物质的量浓度的组合是
A.④⑤⑥ B.①②③④ C.①③④ D.①③④⑤
7.已知白磷分子(P4)中每个磷原子位于正四面体的顶点,它与氧气反应的某种产物六氧化四磷的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键的数目是
A.10 B
8.几种短周期元素的原子半径及主要化合价如下表:
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6、-2
+2
-2
下列叙述正确的是
A. R的氧化物对应的水化物可能具有两性
B. L、M的单质与稀硫酸反应速率:M>L
C. T、Q的氢化物常态下均为无色气体
D.L、Q形成的简单离子核外电子数相等t
二、填空题(本题包括10小题,第9~16题每小题4分、第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,NA个SO3分子所占的体积约为
B.
C.
D.在常温常压下,46 gNO2和N2O4混合物中所含原子的个数为3NA
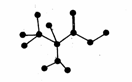 10.右下图是某有机物分子中C、H、O、N四种原子的成键方式示意图。下列关于该有机物的说法正确的是
10.右下图是某有机物分子中C、H、O、N四种原子的成键方式示意图。下列关于该有机物的说法正确的是
A.在一定条件下,可以通过聚合反应生成高分子化合物
B.分子式为C3H7NO2
C.不能和盐酸溶液反应
D.不能和NaHCO3溶液反应生成CO2 x
11.下列离子反应方程式正确的是
A.将少量SO2气体通入NaClO溶液中:2ClO-+SO2+H2O SO
SO +2HClO
+2HClO
B.硫化氢气体通入硝酸铅溶液产生黑色硫化铅沉淀:H2S+Pb2+ PbS↓+ 2H+
PbS↓+ 2H+
C.向偏铝酸钠溶液中通入过量CO2:AlO CO2+2H2O
CO2+2H2O Al(OH)3↓+HCO
Al(OH)3↓+HCO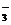
D.溴化亚铁溶液中滴入过量的新制氯水:2Fe2++Cl2 2Fe3++2Cl-
2Fe3++2Cl-
12.某碱式盐的化学式为Mg(1+x)(CO3)x(OH)2取
A.1
B
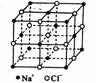 13.假设某氯化钠米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同,其结构模型如右图所示,则这种纳米颗粒的表面微粒数占总微粒数的百分数是
13.假设某氯化钠米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同,其结构模型如右图所示,则这种纳米颗粒的表面微粒数占总微粒数的百分数是
A.66.7% B.87.5% C.92.9% D.96.3%
14.有t℃的a g KCl不饱和溶液,其质量分数为ω1,采取措施后使其变为b g饱和溶液,其溶质质量分数为ω2,下列说法正确的是
A.a一定小于或等于b B. aω1一定等于b ω2
C.t℃时KCl溶解度一定大于100ω1 D. ω1一定大于ω2
15.已知某温度下0.1 mol?L-1的NaHB溶液中c(H+)>c(OH-),则下列关系中一定正确的是
A.c(Na+)=c(HB-)+
C.c(H+)?c(OH-)=10-14 D.溶液的pH=1
16.如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图。
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2=2CO2+4H2O。下列有关该电池的说法错误的是
A.
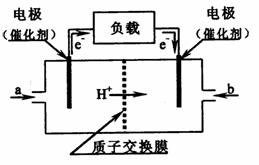 |
右边的电极为电池的负极,b处通入的是空气
B. 左边的电极为电池的负极,a处通入的是甲醇
C. 电池负极的反应式为:2CH3OH+2H2O-12e-=2CO2+12H+
D. 电池正极的反应式为:3O2+12H++12e-=6H2O
17.科学家发现,不管化学反应是一步完成或分几步完成,该反应的热效应是相同的。已知在
A.在相同条件下:
B.1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ
C.在相同条件下:C(石墨)+CO2(g)=2CO(g); ΔH=+172.5 kJ?mol-1
D.若金刚石燃烧热大于石墨的燃烧热,则石墨转变为金刚石需要吸热
18.在一固定体积的密闭容器中,可逆反应,nA(g)+mg(B) pC(g)已经达到平衡状态。已知n+m>p,正反应为放热反应。下列分析结论中正确的是
pC(g)已经达到平衡状态。已知n+m>p,正反应为放热反应。下列分析结论中正确的是
①升温,c(B)/c(C)的值变小;②降温,平衡体系内混合气体的平均相对分子质量变小;③增加B的物质的量,A的转化率增大;④使用催化剂,气体总的物质的量不变;⑤加压使密闭容器的容积变小,A或B的浓度则变大;⑥若A的反应速率为v(A),则v(B)=v(A)n/m。
A.③④⑤ B.②③④ C. ③④⑥ D.①②③
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共20分)
19.(3分)下列实验操作能达到的预期效果的是______________。
A.用pH试纸测定某液体是否为酸。
B.实验室制取乙烯时必须将温度计的水银球插入反应液中,以控制反应液的温度。
C.分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现。
D.向2 mL 2%硝酸银溶液中滴加稀氨水至产生的沉淀恰好溶解即得银氨溶液。
E.向20 mL沸水中滴加数滴饱和FeCl3的溶液,加热片刻,可制得Fe(OH)3胶体。
F.将10滴溴乙烷加入1 mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
20.(17分)在实验室常用锌粒跟稀硫酸起反应而制得的氢气,含有水蒸气等杂质;被干燥后,经催化剂的作用,再跟干燥的氮气起反应,生成氨气。
(1)根据上述要求,小强同学尝试安装了以下装置。
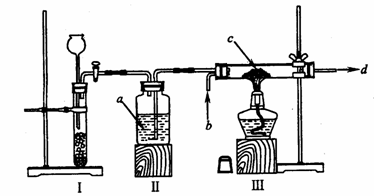 |
试填空:
① 请指出上述装置中的错误之处:________________;________________。
② 装置Ⅲ的作用是________________。
③ 写出箭头所标试剂的名称:a_________; b__________; c__________; d_________。
再简答下列问题:
(2)为什么不能用浓硫酸跟锌起反应来制得氢气?
________________________________________________________________。
(3)为什么不能用铜跟稀硫酸起反应来制取氢气?
________________________________________________________________。
(4)干燥的氢气里可能混用二氧化硫、硫化铜、氮气、二氧化碳等杂质。把这种氢气顺次通过硝酸铅溶液和氢氧化钠溶液,每种溶液能除去什么杂质?
________________________________________________________________。
(5)怎样检验生成的氨气?
________________________________________________________________。
四、(本题包括2小题,共16分)
21.(8分)将4 mol SO3气体和4 mol NO置于
2SO3(g) 2SO2+O2;2NO+O2
2SO2+O2;2NO+O2 2NO2。
2NO2。
(1) 当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量为____________mol。
(2) 当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和______,或NO和________(填分子式)。
(3) 若在另外一个 2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol?L-1、0.2 mol?L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol?L-1、0.2 mol?L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
A. c(NO)=0.35 mol?L-1或c(NO)=0.09 mol?L-1
B. c(NO2)=0.4 mol?L-1
C. c(NO2)=0.35 mol?L-1
D. c(O2)=0.2 mol?L-1或c(NO)=0.4 mol?L-1
22.(8分)下图是某些常见物质的转化关系图,图中部分反应物或生成物没有列出。其中A是农业生产中常用的化肥,且分解得到相等物质的量的B、C、D。B是直线型非极性分子, D、J是工业上用途很广的两种重要的化工原料,H、I是典型的大气污染物,E是一种耐高温材料。
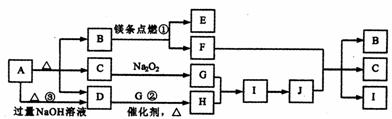 |
请按要求填空:
(1) D的电子式_________,其分子的空间结构为_____________形。
(2) 反应①、②的化学方程式为:
①______________________________;②_______________________。
(3) 反应③的离子方程式为_________________________________________。
五、(本题包括2小题,共23分)
23.(10分)有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色;A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液反应。
(1)A可能发生的反应有__________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是_____________、________________。
(3)B分子中没有支链,其结构简式是_________,与B具有相同官能团的同分异构体的结构简式是__________________。
(4)由B制取A的化学方程式是_______________。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:
 |
天门冬氨酸的结构简式是__________________________。
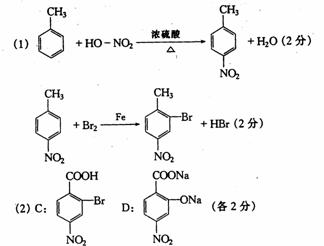
24.(13分)据报道,目前抑制结核杆菌的药物除雷米封外,PAS―Na(对氨基水杨酸钠)也是其中一种,它与雷米封同时服用,可以产生协同作用。已知:
请回答下列问题:
(1)
 |
写出下列反应的化学方程式:
A→B:______________________
(2)写出下列物质的结构简式:
C__________________,D_______________________。
(2) 指出反应类型:反应Ⅰ___________,反应Ⅱ______________,反应Ⅲ___________。
(3) 所加试剂名称:X___________,Y___________________。
六、(本题包括2小题,共17分)
25.(7分)已知酸性高锰酸钾溶液可以氧化亚铁离子和草酸根离子,其离子反应式为:
MnO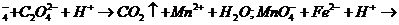 Fe3++Mn2++H2O。
Fe3++Mn2++H2O。
现称取草酸亚铁[FeC2O4]样品
(1)
试分别配平下列两个离子反应式。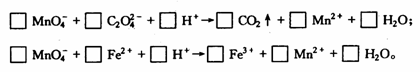
(2) 求样品中草酸亚铁的质量分数。
26.(10分)乙烯和乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)=_________。
(2)当a=1时,且反应后CO和CO2混合气体的物质的量为反应前氧气的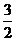 时,则b=______,得到的CO和CO2的物质的之比n(CO):n(CO2)=__________________。
时,则b=______,得到的CO和CO2的物质的之比n(CO):n(CO2)=__________________。
(3)a的取值范围是____________________________。
(4)b的取值范围是____________________________。
苏州市2006届高三教学调研测试
1.B 2.C 3.D 4.C 5.B 6.C 7.B 8.A 9.BD 10.AB 11.BC 12.C 13.D 14.C 15.B 16.A 17.CD 18.A
19.B、D、E
20.(1)①装置Ⅰ的长颈漏斗下端尖嘴未插入酸液内;装置Ⅱ洗瓶长、短导管反向连接。
②在催化剂存在下,将氢气、氮气混合加热制备氨气。
③a.浓硫酸;b.氮气;c.铁粉;d.氨气、氢气和氮气的混合气体。
(2)因为浓硫酸具有强氧化性,跟锌反应生成二氧化硫。t
(3)因为铜不活动,不能从稀硫酸中置换氢。
(4)硝酸铅溶液能除去硫化氢。
氢氧化钠溶液能除去二氧化碳和二氧化硫。x
(4) 使湿润的红色石蕊试纸变蓝(或答闻气味,或跟盐酸生成白烟等)。
21.(1)0.2 mol (2)SO2、NO2 (3)A、C
22.

(2)①2Mg+CO2 2MgO+C
2MgO+C
②4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)NH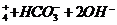
 NH3↑+CO
NH3↑+CO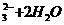
23.(1)①③④
(2)碳碳双键 羧基
(3)HOOC-CH=CH-COOH CH2=C(COOH)2
(4)HOOC―CH=CH―COOH+2CH3OH CH3OOCCH=CHCOOOCH3+2H2O
CH3OOCCH=CHCOOOCH3+2H2O
(5)HOOCCH2CH(NH2)COOH
24.
 |
(3)取代反应 氧化反应 还原反应
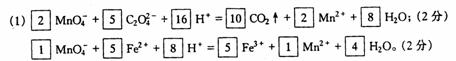 |
(4)酸性高锰酸钾溶液 NaHCO3溶液
25.
(2)80.0%
26.(1)1:1 (2)3,1:3 (3)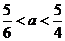 (4)
(4)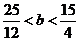
附第26题的解题思路:
(1)n(H)=5 mol,氧气完全反应无剩余,
n(C2H6)+n(C2H4)=1 mol,
6n(C2H6)+4n(C2H4)=5 mol
解得:n(C2H6)=n(C2H4)=0.5 mol。
(2)a=1,n(C)=2 mol, n(CO)+n(CO2)=2 mol
故n(O2)=3 mol,
2n(O2)=0.5 mol, n(CO2)=1.5 mol。
(3)
假设两种极端,全部满足n(H)=5 mol,①全部为乙烷:a=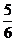 ;②全部乙烯:a=
;②全部乙烯:a=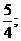 故混合气体必须介于两者之间
故混合气体必须介于两者之间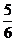 <a<
<a<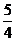 。
。
(4)
①耗氢量最少,只生成CO应全部是乙烷为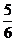 mol 。
mol 。
C2H5+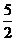 O2→2CO+3H2O
O2→2CO+3H2O
1 2.5
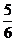 b b=
b b= mol;
mol;
②耗氧量最多,只生成CO2,应全部是乙烯为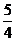 mol。
mol。
C2H4+3O2→2CO2+2H2O
1 3
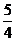 b b=
b b=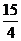 mol;
mol;
所以b的取值范围:  <b<
<b<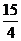 。
。