摘要:12.某碱式盐的化学式为Mg(1+x)(CO3)x(OH)2取1.55 g该固体恰好与10 mL 4mol?L-1硝酸完全反应.所得溶液仅为Mg(NO3)2溶液.则x值为 A.1 B.2 C.3 D.5
网址:http://m.1010jiajiao.com/timu_id_3894[举报]
某碱式盐的化学式为Mg(1+x)(CO3)x(OH)2,取1.55 g该固体恰好与10 mL 4 mol·L-1硝酸完全反应,所得溶液仅为Mg(NO3)2溶液,则x值为
A.1 B.2 C.3 D.5
查看习题详情和答案>>海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
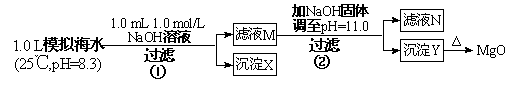
| 模拟海水中的离子 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 浓度(mol/L) | 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.84×10-6;Ksp[Mg(OH)2]=5.61×10-12。
(1)沉淀物X的化学式为 ,生成X的离子方程式 。
(2)滤液N中存在的阳离子除Na+外还有 其物质的量浓度为 mol/L。
(3)若使2处pH为11,则需加入氢氧化钠固体质量为 g;(保留三位有效数字)
若使Y为纯净物,则2处加入氢氧化钠的质量最大值为 g. (保留三位有效数字)
查看习题详情和答案>>(2012?广州一模)实验室中可用盐酸滴定的方法测定Na2CO3或NaHCO3的含量.测定Na2CO3时,若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时Na2CO3完全转化为NaHCO3;测定NaHCO3时,若用甲基橙作指示剂,逐滴加入盐酸至溶液由黄色变橙色时NaHCO3完全转化为CO2逸出.(化学式量:Na2CO3-106,NaHCO3-84)
(1)分别写出上述转化反应的离子方程式
(2)某天然碱的化学式为xNa2CO3?NaHCO3?2H2O,为了测定其组成,取0.3320g样品于锥形瓶中,加适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1的盐酸滴定至溶液由红色变无色,消耗盐酸20.00mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸30.00mL.
①实验时用到的玻璃仪器有烧杯、胶头滴管、锥形瓶、
②该天然碱化学式中x=
(3)某学习小组在实验室中制备Na2CO3,假设产品中含有少量NaCl、NaHCO3杂质,设计实验方案进行检验,完成下表.
限选试剂:0.1000mol?L-1盐酸、稀硝酸、AgNO3溶液、酚酞、甲基橙、蒸馏水
查看习题详情和答案>>
(1)分别写出上述转化反应的离子方程式
CO32-+H+=HCO3-
CO32-+H+=HCO3-
、HCO3-+H+=CO2↑+H2O
HCO3-+H+=CO2↑+H2O
.(2)某天然碱的化学式为xNa2CO3?NaHCO3?2H2O,为了测定其组成,取0.3320g样品于锥形瓶中,加适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1的盐酸滴定至溶液由红色变无色,消耗盐酸20.00mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸30.00mL.
①实验时用到的玻璃仪器有烧杯、胶头滴管、锥形瓶、
玻璃棒、酸式滴定管
玻璃棒、酸式滴定管
.②该天然碱化学式中x=
2
2
.(3)某学习小组在实验室中制备Na2CO3,假设产品中含有少量NaCl、NaHCO3杂质,设计实验方案进行检验,完成下表.
限选试剂:0.1000mol?L-1盐酸、稀硝酸、AgNO3溶液、酚酞、甲基橙、蒸馏水
| 实验步骤 | 结果分析 |
| 步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解, 滴加足量稀硝酸酸化,再滴加几滴AgNO3溶液 滴加足量稀硝酸酸化,再滴加几滴AgNO3溶液 . |
有白色沉淀生成,说明产品中含有NaCl. |
| 步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1. 再向已变无色的溶液中滴加几滴甲基橙,继续用该盐酸滴定至溶液由黄色变为橙色 再向已变无色的溶液中滴加几滴甲基橙,继续用该盐酸滴定至溶液由黄色变为橙色 ,记录消耗盐酸的体积V2. |
V2>V1 V2>V1 ,说明产品中含有NaHCO3. |
(2012?枣庄二模)某实验小组用工业上废弃固体(主要成分为Cu2S和Fe2O3混合物)制取铜和FeCl3固体,设计的操作流程如下:
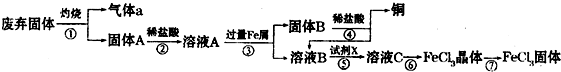
(1)除酒精灯和铁架台或三角架外,①中所需的容器为
(2)固体B加入稀盐酸后,④的操作是
(3)试剂x的化学式为
(4)在实验室中,用36.5%(密度为1.19g?mL-1)的盐酸,配制1L 3mol?L-1的盐酸,则需量取36.5%的盐酸
(5)简述溶液C中所含金属阳离子的检验方法
(6)第⑦步操作中,所需装置如图所示:
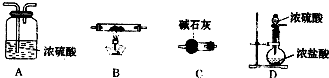
①按气流方向从左到右的顺序,各装置的连接顺序为
②C的作用是
查看习题详情和答案>>

(1)除酒精灯和铁架台或三角架外,①中所需的容器为
坩埚
坩埚
,①和⑥中都用到的仪器为玻璃棒
玻璃棒
.(2)固体B加入稀盐酸后,④的操作是
过滤、洗涤
过滤、洗涤
.(3)试剂x的化学式为
H2O2
H2O2
,X与溶液B反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.(4)在实验室中,用36.5%(密度为1.19g?mL-1)的盐酸,配制1L 3mol?L-1的盐酸,则需量取36.5%的盐酸
252.1
252.1
mL.(5)简述溶液C中所含金属阳离子的检验方法
取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+
取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+
.(6)第⑦步操作中,所需装置如图所示:

①按气流方向从左到右的顺序,各装置的连接顺序为
DABC
DABC
.②C的作用是
吸收HCl和防止空气中的水蒸气进入
吸收HCl和防止空气中的水蒸气进入
.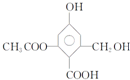 (2012?岳阳二模)已知某有机物X的结构简式如图.下列有关叙述不正确的是( )
(2012?岳阳二模)已知某有机物X的结构简式如图.下列有关叙述不正确的是( )